题目内容
合成氨工业对化学工业和国防工业具有重要意义。
(1)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆过程
_______________________________________________________________
②氨水中水电离出的![]() (填写“>”、“<”或“=”)
(填写“>”、“<”或“=”)
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为__________________。
(2)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式___________________________;
②在标准状况下,每生成1mol B,转移电子的物质的量为_________mol。
(3)I 在某压强恒定的密闭容器中加入2mol N2和4 mol H2,发生如下反应:
N2(g)+3H2 (g)![]() NH3(g)
NH3(g)![]()
达到平衡时,体积为反应前的三分之二。求:
①达到平衡时,N2的转化率为_________。
②若向该容器中加入amol N2、b mol H2、c mol NH3,且a、b、c均>0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:
①_________②(填“>”、“<”或“=”)。
Ⅱ 若将2 mol N2和4 mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。
③试比较平衡时NH3的浓度I_________Ⅱ (填“>”、“<”或“=”)。
(1)①NH3 +H2O![]() NH3 ?H2O
NH3 ?H2O ![]() NH4++OH-
NH4++OH-
②<
③![]()
(2)①![]() (催化剂要注明是铜)
(催化剂要注明是铜)
②6
(3)①50%
②>
③>

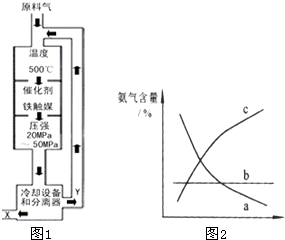 (2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成
(2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成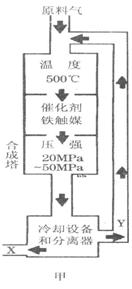
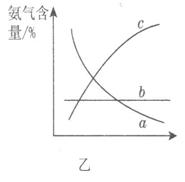
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系: