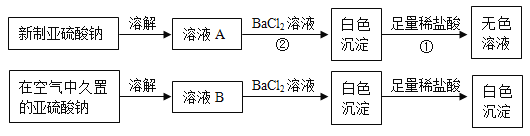
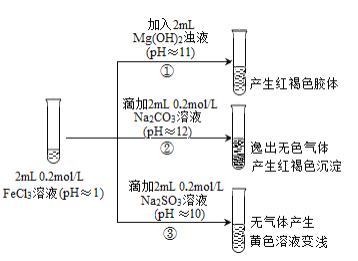
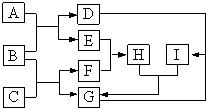
题目内容
【题目】(1)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为:__________________填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)____c(CO32-) (填“>”、“<”或“=”)。
(2)已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是________ 。 (填写序号);b中氯离子的浓度为_______mol/L。
【答案】 b>a>c > b>a>d>c 9×10-10
【解析】(1)①已知酸性醋酸>碳酸>次氯酸,酸越强,对应的钠盐的pH越小,三种溶液pH由大到小的顺序为b>a>c,故答案为:b>a>c;
②溶液a的pH大于8,说明HCO3-水解程度大于电离程度,则溶液中c(H2CO3)>c(CO32-),故答案为:>;
(2)100mL 0.2molL-1AgNO3溶液中Ag+浓度为0.2mol/L抑制沉淀溶解平衡,c100mL 0.1molL-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;d100mL 0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为b>a>d>c,100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加入氯化银后,氯离子浓度为![]() =9×10-10mol/L,故答案为:b>a>d>c;9×10-10。
=9×10-10mol/L,故答案为:b>a>d>c;9×10-10。