题目内容
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。其中一种方法是还原沉淀法,
该法的工艺流程为:CrO42- Cr2O72-
Cr2O72-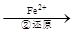 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4·7H2O。
写出第②步中反应的离子方程式_______________________________________________。
该法的工艺流程为:CrO42-
 Cr2O72-
Cr2O72-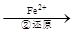 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第①步存在平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)若该平衡处在强酸性环境,则溶液显________色。
(2)能说明第①步反应达平衡状态的是 。
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要 mol的FeSO4·7H2O。
写出第②步中反应的离子方程式_______________________________________________。
⑴橙 ⑵ c
⑶ 6 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
⑶ 6 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
试题分析:本题考查的是化学平衡理论和氧化还原理论。(1)(2)小题的关键是理解化学平衡状态的标志是:生成物与反应物的浓度不再改变,v(正)=v(逆) 。第(3)题抓住化合价变化这一特征入手, Cr2O72-变为Cr3+, 化合价降低3×2,而Fe2+变为Fe3+化合价升高1,根据氧化还原守恒规律,1molCr2O72-离子,需要6mol的FeSO4
 7H2O。
7H2O。
练习册系列答案
相关题目
 、
、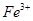 、
、 、
、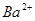 、
、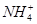 等阳离子。某同学进行如下实验:
等阳离子。某同学进行如下实验: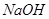 溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。
溶液至溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体。