��Ŀ����
����Ŀ��ij�о�С�����ö����ķ�������Al���ᷴӦ�Ŀ�����
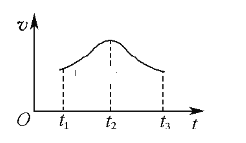
(1)ʵ������˿�������������(v)��ʱ��(t)�Ĺ�ϵ����ͼ��ʾ����t1��t2ʱ����ڷ�Ӧ�����ӿ����Ҫԭ����__________��t2��t3ʱ����ڷ�Ӧ������������Ҫԭ����___________________________________
(2)ijͬѧȡ���������Ũ�ȵ� a ϡ���ᡢb ���ᡢc ���� ��������Һ�ֱ�������������۽�������ʵ�飬��ʼʱ������Һ�з�Ӧ�����ɿ쵽����˳����_________________����Ӧ��ϲ�������������ɴ�С˳����_________________����ͬ���������������������������ش�
���𰸡���Ӧ���ȣ���Һ�¶����� ��Һ��C(H+)��С a>b>c a>b=c
��������
(1)Al���ᷴӦ���ȣ��淴Ӧ���У������ӱ����ģ�������Ũ�Ƚ��ͣ�
(2)�������У�����ΪһԪ���ᣬ����ΪһԪǿ�ᣬ����Ϊ��Ԫǿ�ᣬ��Ũ��ʱ����Һ��c��H+����С˳��Ϊa��b��c��c��H+��Խ��Ӧ����Խ���Դ˽��
(1) Al���ᷴӦ���ȣ��淴Ӧ���У�������Ũ�Ƚ��͡�����t1��t2ʱ����ڷ�Ӧ�����ӿ����Ҫԭ���Ƿ�Ӧ���ȣ���Һ�¶����ߣ�t2��t3ʱ����ڷ�Ӧ������������Ҫԭ������Һ��c(H+)��С��
(2)�������У�����ΪһԪ���ᣬ����ΪһԪǿ�ᣬ����Ϊ��Ԫǿ�ᣬ��Ũ��ʱ����Һ��c��H+����С˳��Ϊa��b��c��c��H+��Խ��Ӧ����Խ����ʼʱ������Һ�з�Ӧ���ʿ���˳����a��b��c�����������Ũ�ȵ� ϡ���ᡢ ���ᡢ���ᣬ���ʵ�����ȣ�������������������ɴ�С˳����a>b=c��

����Ŀ����ѧ�ϳ���ȼ�շ��ⶨ�л���ķ���ʽ�����ַ������ڵ�¯����ʱ�ô���������������Ʒ�����ݲ��������ȷ���л������ɡ���ͼ��ʾ������ȼ�շ�ȷ���л������ʽ�ij���װ�á�
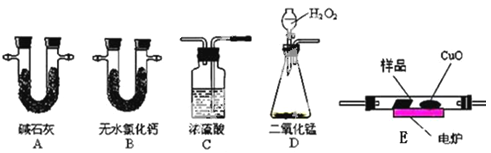
ʵ��̽��С���ȡһ����������Ʒ��ֻ��C��H��O����Ԫ���е����ֻ����֣�������ʵ��,ͨ���ⶨ������CO2��ˮ������ȷ���л������ɣ���ش��������⣺
��1��C��Ũ����������dz�ȥ�����е�ˮ������ʵ��װ�õ�����˳��Ӧ�ǣ�___________��ÿ��װ��ֻ��һ�Σ���
��2��ʵ�����ݼ�¼�ʹ���
������ʵ����� | ȼ���л�������� | �� | �� | ||
ʵ��ǰ���� | ʵ������� | ʵ��ǰ���� | ʵ������� | ||
1 | m1 | m2 | m3 | m4 | m5 |
�ϱ��Т١��ڷֱ�ָ�ĸ�װ�ã�____________ �� _____________��
��3����ʵ��ȷ��ȡ4.4 g��Ʒ����ȼ�պ��ò���CO28.8 g��ˮ����3.6g��Ҫȷ�����л���ķ���ʽ��������֪����������________��
��4����ͬ�����£������л�����������������Է�������Ϊ22�������ĺ˴Ź����������������壬��ǿ�ȱ�Ϊ3:1����ͨ������ȷ�����л���Ľṹ��ʽ___________������л�����Է���������ͬ������һ�ȴ�����_____�֡�
����Ŀ������ʵ���У�������ͷ���������У��ҷ��������������
ʵ��Ŀ�� | ������ | ������ | |
A | ��ȥ���������е��������� | �ӱ��� | ���� |
B | ����̼���ƺ�̼��������Һ | �ֱ�μӳ���ʯ��ˮ | �ֱ��������Һ |
C | �������������Ƿ����� | ���� | ���������ữ�� |
D | �Ƚ���Ԫ�ء���Ԫ�صķǽ�����ǿ�� | �ֱ�����Ȼ��⡢�⻯�⣬�Ƚ����ȶ��� | �ڵ��۵⻯����ֽ�ϵμ���ˮ |
A.AB.BC.CD.D
����Ŀ����E��F�����ܱ�������,��һ�������·�����Ӧ��E(g)��F(s)![]() 2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
2G(g)�����Թ��������ƽ��ʱG���������(%)���¶Ⱥ�ѹǿ�ı仯���±���ʾ��
ѹǿ/MPa �������/% �¶�/�� | 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
��b��f ��915�桢2.0MPaʱE��ת����Ϊ60%���۸÷�Ӧ����S��0 ��K(1000��)��K(810��)
�����١�������ȷ����( )
A.4��B.3��C.2��D.1��