题目内容
10.已知SO2和H2O2在溶液中发生如下反应:SO2+H2O2═H2SO4.取0.6g某含硫、铁的物质,将它在氧气中灼烧,使硫全部转化为SO2,用稀的过氧化氢溶液吸收.吸收液恰好与40mL 0.5mol/LNaOH溶液反应.求:(1)此物质中硫的质量分数
(2)此物质中铁与硫的原子个数之比(取整数比)
分析 (1)反应的关系式为SO2~H2SO4~2NaOH,n(NaOH)=0.04L×0.50mol/L=0.02mol,根据S元素守恒可知化合物中S的质量,进而可计算质量分数;
(2)由S元素守恒计算物质中S的物质的量,结合0.6g某含硫、铁的物质计算Fe的物质的量,然后计算原子个数比.
解答 解:(1)n(NaOH)=0.04L×0.50mol/L=0.02mol,
由反应的关系式SO2~H2SO4~2NaOH可知,n(SO2)=0.01mol,
则硫和铁组成的化合物中含有0.01molS,
m(S)=0.01mol×32g/mol=0.32g,
则ω(S)=$\frac{0.32g}{0.6g}$×100%=53.3%,
答:硫的质量分数为53.3%;
(2)由上述计算可知,硫和铁组成的化合物中含有0.01molS,则n(Fe)=$\frac{0.6g-0.32g}{56g/mol}$=0.005mol,则铁与硫的原子个数之比为0.005mol:0.01mol=1:2,
答:铁与硫的原子个数之比为1:2.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、复分解反应得到关系式为解答的关键,注意元素守恒法的计算及应用,题目难度不大.

练习册系列答案
相关题目
1.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
5.25℃时,将pH=2和pH=5的硫酸溶液等体积混合后,溶液的pH为( )
| A. | 2.3 | B. | 4.7 | ||
| C. | 3.5 | D. | 以上答案都不正确 |
15.光化学烟雾是一次污染物(如氮的氧化物、碳氢化合物等)发生光化学反应后生成的二次污染物,主要含有臭氧、过氧硝酸酯等.下列有关光化学烟雾的说法不正确的是( )
| A. | 光化学烟雾具有氧化性 | |
| B. | 汽车尾气是造成光化学烟雾的主要原因之一 | |
| C. | 光化学烟雾对人体没有危害 | |
| D. | 光化学烟雾一般出现在强日照条件下 |
2.学生常用的涂改液中含有许多挥发性的有害物质,二氯甲烷(CH2Cl2)是其中的一种.下面有关二氯甲烷的几种说法:
①它是由碳、氢、氯三种元素组成的化合物;
②它是由氯气和甲烷组成的混合物;
③它的分子中碳、氢、氯的原子个数比为1:2:2;
④它是由多种原子构成的混合物.这些说法中正确的是( )
①它是由碳、氢、氯三种元素组成的化合物;
②它是由氯气和甲烷组成的混合物;
③它的分子中碳、氢、氯的原子个数比为1:2:2;
④它是由多种原子构成的混合物.这些说法中正确的是( )
| A. | ①③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
20.进行下列实验肯定不能获得成功的是( )
| A. | 用pH试纸鉴别浓硫酸与浓硝酸 | |
| B. | 用淀粉碘化钾溶液区分二氧化氮和二氧化碳 | |
| C. | 用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫 | |
| D. | 常温下用铜片和浓HNO3反应制取二氧化氮气体 |
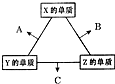 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O. ,反应中NaH作为还原剂.
,反应中NaH作为还原剂.