题目内容
有两种金属组成的混合物粉末32g与足量的稀盐酸反应,生成11.2L(标况)H2,则该混合物的组成可能是:①Fe、Zn ②Al、Cu ③Ag、Mg ④Al、Fe
| A.①②③④ | B.①②③ | C.①③ | D.②③④ |
B
解析试题分析:生成氢气的物质的量=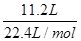 =0.5mol,反应中氢元素的化合价从+1价降低到0价,所以生成0.5mol氢气转移电子的物质的量=0.5mol×2=1.0mol,这说明金属失去1mol电子,消耗金属的质量是32g。Fe、Zn、Al、Mg与盐酸反应时失去1mol电子消耗金属的质量分别是(g)
=0.5mol,反应中氢元素的化合价从+1价降低到0价,所以生成0.5mol氢气转移电子的物质的量=0.5mol×2=1.0mol,这说明金属失去1mol电子,消耗金属的质量是32g。Fe、Zn、Al、Mg与盐酸反应时失去1mol电子消耗金属的质量分别是(g)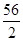 =28、
=28、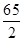 =32.5、
=32.5、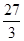 =9、
=9、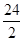 =12,。金属铜和银与盐酸布反应,可以视为无穷大,则根据平均值原理可知组合①Fe、Zn、②Al、Cu、③Ag、Mg均满足,因此答案选B。
=12,。金属铜和银与盐酸布反应,可以视为无穷大,则根据平均值原理可知组合①Fe、Zn、②Al、Cu、③Ag、Mg均满足,因此答案选B。
考点:考查金属与盐酸反应的有关计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
碳有多种单质,下列叙述正确的是(NA表示阿伏加德罗常数)
| A.72g C60中含有0.1NA个碳原子 |
| B.0.5 mol金刚石中含有2NA个碳碳单键 |
| C.1.2g由14C组成的单质中含有0.6 NA个中子 |
| D.在12g石墨片层结构中,含有六元环的个数为0.5 NA |
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A.1molO2作为氧化剂得到的电子数一定为4NA |
| B.在标准状况下,11.2L水中含有分子数为0.5NA |
| C.0.4mol/LNa2SO4溶液中,所含Na+和SO42―总数为1.2NA |
| D.标准状况下,40gSO3所占的体积一定小于11.2L。 |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A.00mL2mol/L葡萄糖溶液中所含分子数为NA |
| B.0.1mol/L Na2CO3溶液中的阴离子总数大于0.1NA |
| C.电解精炼铜时,若阳极质量减少64g,则外电路导线上不一定通过2NA个电子 |
| D.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
NA为阿伏加德罗常数的数值,下列说法中正确的是 ( )
| A.在密闭容器中加入1.5 mol H2和0.5 mol N2,充分反应可得到NH3分子数为NA |
| B.一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA |
| C.1.0 L的0.1 mol·L-1 Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
下列条件下,两种气体分子数一定不相等的是
| A.相同质量、不同密度的N2O和CO2 |
| B.相同体积、相同密度的N2和C2H4 |
| C.相同温度、相同压强、相同体积的NO2和N2O4 |
| D.相同压强、相同体积、相同质量的O2和O3 |
在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为
| A.0.15 mol/L | B.0.10 mol/L | C.0.25 mol/L | D.0.20 mol/L |
设NA代表阿伏加德罗常数的数值,下列说法中不正确的是( )
| A.常温常压下,20 g重甲基(-14CD3)所含的中子数为11NA; |
| B.常温常压下,22.4 L NO气体的分子数小于NA; |
| C.64 g铜发生氧化还原反应,一定失去2NA个电子; |
| D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA; |
设阿伏加德罗常数为NA,下列说法正确的是
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1mol NH3含有的电子数10NA |
| C.常温常压下,22.4 L的氧气含氧原子数为2NA |
| D.常温下,1 L0.1mol·L-1AlCl3溶液中含Al3+数为0.1 NA |