题目内容
【题目】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,并在同一族。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是______,电负性最大的是_______。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。

①该化合物的化学式为_________;
②列式计算该晶体的密度_____g·cm-3(列式即可,不必计算)。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,期中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
【答案】![]() K F K2NiF4
K F K2NiF4 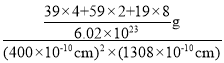 离子键、配位键 [FeF6]3- F-
离子键、配位键 [FeF6]3- F-
【解析】
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素.
由分析可知:A是F,B是K,C是Fe,D是Ni;
(1)Ni2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,故答案为:K;F;
(3)①该晶胞中F原子个数![]() ,K原子个数
,K原子个数![]() ,Ni原子个数
,Ni原子个数![]() ,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
,所以该化合物的化学式为K2NiF4,故答案为:K2NiF4;
②该晶胞的体积![]() ,晶胞质量
,晶胞质量![]() ,故晶体密度
,故晶体密度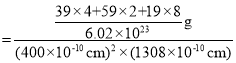 ,故答案为
,故答案为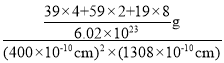 :;
:;
(4)F-、K+和Fe3+三种离子组成的化合物K3FeF6,Fe3+含有空轨道,为中心离子,F-含有孤对电子,为配体,二者之间形成配位键,形成配离子[FeF6]3-,[FeF6]3-与K+之间形成离子键,故答案为:离子键、配位键;[FeF6]3-;F-。