题目内容
【题目】燃煤尾气气和汽车尾是造成空气污染的主要原因。
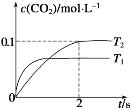
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
据此判断:
①在T2温度下,0~2 s内的反应速率v(N2)=_______mol /(L·s)。
②该反应的ΔH__________0(选填“>”或“<”)。
(2)煤燃烧产生的烟气中有含氮的氧化物NOx,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH<0
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH<0
①若在恒压下,将CH4(g)和NO2(g)置于密闭容器中,发生上述反应。提高NO2转化率的措施有____。
A.加入催化剂 B.降低温度 C.减小投料比[![]() ] D.增大压强
] D.增大压强
②在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等物质的量的NO和NO2。在不同温度下,同时分别发生上述的两个反应,并在t秒时测定其中NOx转化率,绘得图像如图所示:
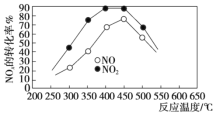
从图中可以得出的结论是:
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,450~600 ℃时NOx转化率随温度升高而减小。推测原因是_____________。
结论二:______________。
【答案】0.025 < BC 在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小 相同温度下NO的转化率比NO2的低
【解析】
对于同一可逆反应,各物质的变化量之比等于化学计量数之比;升高温度,反应速率加快,达平衡的时间缩短,可从达平衡的时间判断温度的高低,并由此判断平衡移动的方向,最终可推出ΔH与0的关系。分析CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH<0反应中反应物与生成物的气体分子数关系,依据平衡移动原理,可得出提高NO2转化率的措施。图中采集的数据是反应进行相同时间后测得,温度低反应速率慢,所以温度低时反应未达平衡,温度高时反应已达平衡,由平衡后温度对反应物转化率的影响,可判断反应的ΔH与0的关系。
(1)①在T2温度下,0~2 s内c(CO2)=0.1mol/L,则依据浓度变化量之比等于化学计量数之比,可得出c(N2)= 0.05mol/L,反应速率v(N2)=![]() =0.025mol /(L·s)。答案为:0.025;
=0.025mol /(L·s)。答案为:0.025;
②由图中可以看出,温度为T1时先达平衡,所以T1>T2,降低温度CO2的转化率大,即降温平衡正向移动,所以该反应的ΔH<0。答案为:<;
(2)①A.加入催化剂,平衡不发生移动,NO2转化率不变,A不合题意;
B.降低温度,平衡正向移动,NO2转化率增大,B符合题意;
C.减小投料比[![]() ],相当于增大n(CH4),平衡正向移动,NO2转化率增大,C符合题意;
],相当于增大n(CH4),平衡正向移动,NO2转化率增大,C符合题意;
D.增大压强,平衡逆向移动,NO2转化率减小,D不合题意;
故选BC。答案为:BC;
②温度低反应速率慢,NOx的转化率小,随着温度的不断升高,反应速率加快,NOx的转化率增大,反应达平衡后,再升高温度,从曲线中才能真正看出平衡受温度的影响情况。
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,说明反应未达平衡;450~600 ℃时NOx转化率随温度升高而减小,说明反应达平衡,且升高温度,NOx转化率减小,平衡逆向移动。推测原因是:在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小。
结论二:比较两条曲线,可看出NO2的转化率大,则相同温度下NO的转化率比NO2的低。答案为:在250~450℃时,反应未达到平衡,温度升高反应正向进行,NOx转化率随温度升高而增大;450~600℃(温度较高)时,反应已达平衡,所以,温度升高平衡向逆反应方向移动,NOx转化率随温度升高而减小;相同温度下NO的转化率比NO2的低。

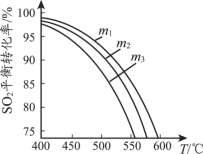
【题目】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为:2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0
2SO3(g) △H< 0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:___________。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图像如下。
反应条件:催化剂、一定温度、容积10 L
实验 | 起始物质的量/mol | 平衡时SO3 物质的量/mol | ||
SO2 | O2 | SO3 | ||
ⅰ | 0.2 | 0.1 | 0 | 0.12 |
ⅱ | 0 | 0 | 0.2 | a |
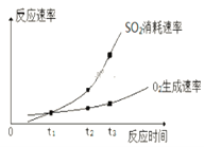
①实验ⅰ中SO2的转化率为______。
②a____0.12(填“>”、“=”或“<”)。
③t1、t2、t3中,达到化学平衡状态的是________。
④ t2到t3的变化是因为改变了一个反应条件,该条件可能是___________。
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2 和O2的物质的量之比m(m=n(SO2)/n(O2))不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为_____。