题目内容
大气中的SO2是造成酸雨的主要污染物。最新研究表明,[N(CH3)4]2SO4(s)能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂[N(CH3)4]2SO4(s)+ SO2 [N(CH3)4]2S2O6(s)ΔH<0 则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为
[N(CH3)4]2S2O6(s)ΔH<0 则用[N(CH3)4]2SO4(s)吸收SO2的适宜条件为
| A.高温高压 | B.低温高压 | C.高温低压 | D.低温低压 |
B
解析试题分析:分析反应[N(CH3)4]2SO4(s)+ SO2 [N(CH3)4]2S2O6(s) ΔH<0知,该反应正向为气体体积减小的放热反应,要想提高SO2的吸收率,使平衡向正向移动,根据平衡移动原理,适宜的条件为低温高压,选B。
[N(CH3)4]2S2O6(s) ΔH<0知,该反应正向为气体体积减小的放热反应,要想提高SO2的吸收率,使平衡向正向移动,根据平衡移动原理,适宜的条件为低温高压,选B。
考点:考查化工生产适宜条件的选择。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
| A.v (N2)=0.05mol·L-1·s-1 | B.v (H2)=0.3mol·L-1·min-1 |
| C.v (N2)=0.2 mol·L-1·min-1 | D.v (NH3)=0.3 mol·L-1·min-1 |
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
| A.0~t2时,v正>v逆 |
| B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ |
| C.t2时刻改变的条件可以是向密闭容器中加C |
| D.Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g) 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: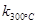 >
>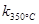 ,且体系中
,且体系中 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
| 时间(s) | 0 | 500 | 1000 | 1500 |
| t1℃ | 20 | 13.96 | 10.08 | 10.08 |
| t2℃ | 20 | a | b | c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么 a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):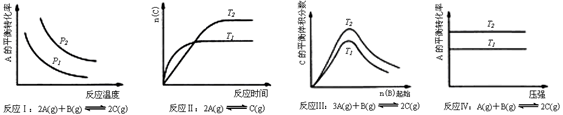
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ:△H>0,p2>p1 |
| B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D.反应Ⅳ:△H<0,T2>T1 |
对于可逆反应H2(g) + I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A.H2(g)的消耗速率与HI(g)的生成速率比为2:1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率不一定相等 |
下列不能用勒夏特列原理解释的是
| A.棕红色NO2加压后颜色先变深后变浅 |
| B.冰镇啤酒打开瓶塞后产生大量泡沫 |
| C.在H2,I2(g)和HI组成的平衡体系中加压后,混合物颜色加深 |
| D.Fe(SCN)3溶液中加入固体KSCN后颜色变化 |
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
下列事实不能用勒夏特列原理来解释的是
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |