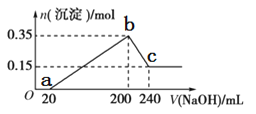
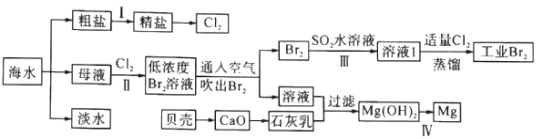
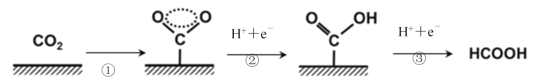
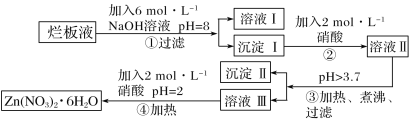
题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)基态o原子的外围电子排布图________________________;基态p3+的最外层电子排布式___________________;n的原子结构示意图____________________。在以上元素中,没有未成对电子的元素有______种。
(2)原子序数为52的元素x在元素周期表中与以上________________元素在同一族(填写以上表中字母对应的元素符号)。
(3)上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p),则I3(o)__I3(p)(填“>”或“<”)。理由是_________________________________________________。
(4)将以上周期表中g、h、i、j四种元素的电负性由大到小排序____________________(用元素符号表示),第一电离能由大到小排序________________________(用元素符号表示)。
【答案】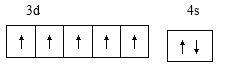 3s23p63d5
3s23p63d5 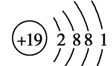 2 O或S > Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
2 O或S > Mn2+的3d轨道电子排布为半充满状态,比较稳定 Si> Al > Mg >Na Si>Mg>Al>Na
【解析】
(1)o、p、n元素分别为锰、铁和钾,原子序数分别为为25、26和19,按电子排布规律写基态o原子的外围电子排布图、基态p3+的最外层电子排布式及n的原子结构示意图;
(2)参照原子序数为54的元素在元素周期表是第5周期0族元素,则可推知原子序数为52的元素x的位置并据此回答;
(3)按电离能的性质和规律回答上表中o、p两个字母表示的元素的第三电离能分别为I3(o)和I3(p)的相对大小及理由;
(4)按电负性规律和电离能的规律回答g、h、i、j四种元素的电负性由大到小排序及第一电离能由大到小排序;
根据元素周期表知,a-p各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn 、Fe。
(1)基态o原子为锰,核电荷数为25,其电子排布简式为[Ar]3d54s2,则外围电子排布图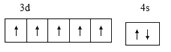 ;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5;n原子为钾,核电荷数19,原子结构示意图
;基态p3+ 为Fe3+,最外层电子排布式3s23p63d5;n原子为钾,核电荷数19,原子结构示意图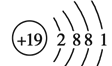 ;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;
;在以上元素中,没有未成对电子的元素有Mg、Ar两种元素,共计2种;
答案为:  ;3s23p63d5 ;
;3s23p63d5 ; ;2;
;2;
(2)稀有气体氙,原子序数为54,位于0族,依次前推,53号元素为碘,52号元素锑,位于VIA族,与O或S同族;
答案为:O或S;
(3)o、p分别表示锰和铁元素,由于Mn2+的3d轨道电子排布为半充满状态,比较稳定,所以第三电离能分别为I3(o) >I3(p);
答案为:>;Mn2+的3d轨道电子排布为半充满状态,比较稳定;
(4)g、h、i、j四种元素分别为钠、镁、铝、硅,同一周期从左到右电负性增大,因此电负性由大到小排序:Si> Al > Mg >Na;同一周期第一电离能从左到右增大,但是IIA、 VA电离能大于邻近元素的电离能,因此第一电离能由大到小排序Si>Mg>Al>Na;
答案为:Si> Al > Mg >Na;Si>Mg>Al>Na。