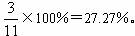题目内容
NH3和Cl2可快速反应:2NH3+3Cl2→N2+6HCl.有100L NH3和Cl2混合气体,充分反应后的混合气体中N2占混合气体的
,则N2的物质的量为(标准状况下数据)( )
| 1 |
| 7 |
| A、0.263mol |
| B、0.483mol |
| C、0.663mol |
| D、0.893mol |
分析:反应2NH3+3Cl2=N2+6HCl中,NH3和Cl2恰好完全反应时,混合气体中N2占混合气体的
,由于氨气与HCl可以反应生成HN4Cl,而充分反应后的混合气体中N2占混合气体的
,则有两类情况:
①Cl2与氨气恰好反应,根据方程式计算混合气体总体积,进而计算氮气体积,据此解答;
②NH3过量时,发生反应8NH3+3Cl2=N2+6HN4Cl,剩余混合气体为氮气、氨气,设Cl2有x L,利用差量法表示出混合气体减少量、生成氮气的体积,再根据反应后混合气体中氮气的含量列方程,进而计算氮气的体积,据此解答.
| 1 |
| 7 |
| 1 |
| 7 |
①Cl2与氨气恰好反应,根据方程式计算混合气体总体积,进而计算氮气体积,据此解答;
②NH3过量时,发生反应8NH3+3Cl2=N2+6HN4Cl,剩余混合气体为氮气、氨气,设Cl2有x L,利用差量法表示出混合气体减少量、生成氮气的体积,再根据反应后混合气体中氮气的含量列方程,进而计算氮气的体积,据此解答.
解答:解:反应2NH3+3Cl2=N2+6HCl中,NH3和Cl2恰好完全反应时,混合气体中N2占混合气体的
,由于氨气与HCl可以反应生成HN4Cl,而充分反应后的混合气体中N2占混合气体的
,则有两类情况:
①Cl2与氨气恰好反应,由方程式可知5体积气体生成7体积气体,故反应后混合气体总体积=100L×
=120L,则氮气体积为120L×
=20L,故其物质的量=
=0.893mol;
②NH3过量时,发生反应8NH3+3Cl2=N2+6HN4Cl,剩余混合气体为氮气、氨气,设Cl2有x L,则:
8NH3+3Cl2=N2+6HN4Cl 气体体积减少
3 1 10
xL
x L
x L
由题意可知,
=
,解得x=
,
故氮气的物质的量=
=0.263mol,
故选AD.
| 1 |
| 7 |
| 1 |
| 7 |
①Cl2与氨气恰好反应,由方程式可知5体积气体生成7体积气体,故反应后混合气体总体积=100L×
| 7 |
| 5 |
| 1 |
| 7 |
| 20L |
| 22.4L/mol |
②NH3过量时,发生反应8NH3+3Cl2=N2+6HN4Cl,剩余混合气体为氮气、氨气,设Cl2有x L,则:
8NH3+3Cl2=N2+6HN4Cl 气体体积减少
3 1 10
xL
| 1 |
| 3 |
| 10 |
| 3 |
由题意可知,
| ||
100L-
|
| 1 |
| 7 |
| 300 |
| 17 |
故氮气的物质的量=
| ||||
| 22.4L/mol |
故选AD.
点评:本题考查混合物计算、根据方程式计算,难度中等,根据反应后氮气的含量确定可能情况是关键,学生容易忽略氨气与HCl反应生成氯化铵情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目