题目内容
【题目】某温度时,在500mL容器中A、B、C三种气体的物质的量随时间的变化曲线如图所示。
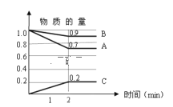
(1)由图中数据分析,该反应的化学方程式为:___________。
(2)反应开始至2min,C的平均反应速率为_________。
(3)在等温等容条件下,该反应达到化学平衡状态的依据是__(填序号)。
a.容器中气体密度不再改变 b.混合气体中c(B)不再改变
c.c(C)=c(A) d.气体的总物质质量不再改变
e.气体的平均摩尔质量不变
(4)在等温等容条件下,反应达平衡时,此时体系的压强是开始时的________倍。
【答案】3A+B![]() 2C 0.2 mol/(L·min) be 0.9
2C 0.2 mol/(L·min) be 0.9
【解析】
(1)在2min内A、B、C三种物质的物质的量的比等于化学方程式中化学计量数的比,得到其相应的化学方程式;
(2)根据V=![]() 计算;
计算;
(3)根据可逆反应达到平衡状态时 任何物质的浓度不变;物质的量的含量不变,化学反应速率不变分析判断;
(4)在等温等容条件下,体系的压强比等于气体的物质的量的比。
(1)根据图示A、B消耗,是反应物,C是生成物;在2min内A减少0.3mol,B减少0.1mol,C增加0.2mol,最终2min时反应达到平衡状态,故化学反应速率A:B:C=3:1:2,所以化学方程式为:3A+B![]() 2C;
2C;
(2)V=![]() =
=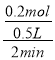 =0.2 mol/(L·min);
=0.2 mol/(L·min);
(3) a.反应前后气体的质量不变,容器的容积不变,因此任何情况下容器中气体密度都不会改变,因此不能据此判断反应是否处于平衡状态,a错误;
b.若反应达到平衡他,混合气体中任何一组分的浓度不变,故若c(B)不再改变 ,反应处于平衡状态,b正确;
c.c(C)=c(A)反应可能处于平衡状态,也可能未处于平衡状态,故不能据此判断平衡状态,c错误;
d.该反应是反应前后气体的质量始终不变,因此若反应后气体的总质量不变,不能判断为平衡状态,d错误;
e.该反应是反应前后气体物质的量改变的反应,由于气体的质量始终不变,因此若气体的平均摩尔质量不变,则气体的物质的量不变,反应处于平衡状态,e正确;
故合理选项是be;
(4)在反应开始时气体的总物质的量为n(开始)=2mol,反应达到平衡时气体的总物质的量n(平衡)=0.9mol+0.7mol+0.2mol=1.8mol,在等温等容条件下,体系的压强比等于气体的物质的量的比,所以平衡时的压强为p(平衡)=![]() p(开始)=0.9p(开始),即在等温等容条件下,反应达平衡时,此时体系的压强是开始时的0.9倍。
p(开始)=0.9p(开始),即在等温等容条件下,反应达平衡时,此时体系的压强是开始时的0.9倍。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案