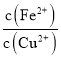题目内容
【题目】25℃时,NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,将0.5mol(NH4)2SO4溶于水中,向所得溶液中滴加aL氨水后溶液呈中性,据此判断下列说法中不正确的是( )
A.滴加氨水的过程中,水的电离平衡将正向移动
B.滴加aL氨水后的溶液中,n(NH4+)=200n(NH3·H2O)=1mol
C.所滴加氨水的浓度为![]() mol·L-1
mol·L-1
D.滴加aL氨水后的溶液中各离子浓度大小为c(NH4+)=2c(SO42-)>c(H+)=c(OH-)
【答案】A
【解析】
A.铵根离子水解促进水的电离,硝酸铵溶液中铵根离子水解显酸性,溶液中加入氨水是弱碱溶液,抑制水的电离,水的电离平衡向左移动,故A错误;
B.将0.5mol(NH4)2SO4溶于水,向该溶液滴加aL 氨水后溶液呈中性,c(H+)=c(OH)=107mol·L1,根据电荷守恒,c(NH4+)=2 c(SO42-),设混合后溶液体积为1L,c(NH4+)=2 c(SO42-)=1mol/L,则n(NH4+)=1mol;根据一水合氨电离平衡得到:NH3H2ONH4++OH-,NH3H2O的电离平衡常数Kb=2×10-5 molL-1,则平衡常数K= =
=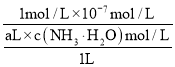 =2×10-5 molL-1,计算得到c(NH3H2O)=
=2×10-5 molL-1,计算得到c(NH3H2O)=![]() mol/L,n(NH3H2O)=
mol/L,n(NH3H2O)=![]() mol,滴加aL氨水后的溶液中,n(NH4+)=200n(NH3H2O)=1mol,故B正确;
mol,滴加aL氨水后的溶液中,n(NH4+)=200n(NH3H2O)=1mol,故B正确;
C.设所加氨水的浓度为z mol·L1,根据物料守恒,滴加a L氨水后溶液中n(NH3·H2O)+ n(NH4+)=1mol+z mol·L1×a L,联立n(NH4+)=200n(NH3·H2O)=1mol,计算得到z=![]() ,故C正确;
,故C正确;
D.溶液中存在电荷守恒,c(NH4+)+c(H+)=c(OH-)+2c(SO42-),得到c(NH4+)=2 c(SO42-),c(H+)=c(OH-),得到c(NH4+)=2 c(SO42-)>c(H+)=c(OH-),故D正确;
故选A。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案