题目内容
【题目】计算后填空:
(1)在标准状况下,448 mL某气体的质量为0.64 g,计算这种气体的相对分子质量为________。
(2)某氯化铁与氯化钠的混合液,已知c(Fe3+)=0.2 mol·L-1,c(Cl-)=1 mol·L-1。则c(Na+)为 。
(3)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为 。
(4)V L Fe2(SO4)3溶液中含Fe3+ m g,则溶液中SO42-的物质的量浓度为 mol·L-1。
(5)在无土栽培中,配制1 L内含5 mol NH4Cl、1.6 mol KCl、2.4 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需KCl、NH4Cl的物质的量分别为 _____________ 、 ________ 。
(6)如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为 。

【答案】
(1)32;
(2)0.4 mol·L-1;
(3)24;
(4)3m/112V;
(5)6.4mol;0.2mol
(6)7:2 或4:5
【解析】
试题分析:(1)标准状况下,448mL气体的物质的量为:![]() =0.02mol,该气体的摩尔质量为:
=0.02mol,该气体的摩尔质量为:![]() =32g/mol,故答案为:32;
=32g/mol,故答案为:32;
(2)溶液呈电中性,根据电荷守恒3c(Fe3+)+c(Na+)=c(Cl-),则:3×0.2molL-1+c(Na+)=1molL-1,解得c(Na+)=0.4 molL-1,故答案为:0.4 molL-1;
(3)19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则19gRCl2的物质的量为0.4mol×![]() =0.2mol,RCl2的摩尔质量为
=0.2mol,RCl2的摩尔质量为![]() =95g/mol,则RCl2的相对分子质量为95,所以R的相对原子量为:95-35.5×2=24,故答案为:24;
=95g/mol,则RCl2的相对分子质量为95,所以R的相对原子量为:95-35.5×2=24,故答案为:24;
(4)VLFe2(SO4)3溶液中含Fe3+mg,含有铁离子的物质的量为:![]() =
=![]() mol,溶液中含有硫酸根离子的物质的量为:
mol,溶液中含有硫酸根离子的物质的量为:![]() mol×
mol×![]() =
=![]() mol,则溶液中SO42-的物质的量浓度为:
mol,则溶液中SO42-的物质的量浓度为: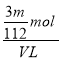 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() ;
;
(5)在无土栽培中,配制1L内含5molNH4Cl、1.6molKCl、2.4molK2SO4的某营养液,该培养液中含有钾离子的总物质的量为:1.6mol+2.4mol×2=6.4mol,根据钾离子守恒,需要氯化钾的物质的量为6.4mol;需要配制的溶液中含有氯离子的物质的量为:5mol+1.6mol=6.6mol,其中6.4mol氯化钾中提供了6.4mol氯离子,则还需要氯化铵的物质的量为:6.6mol-6.4mol=0.2mol,故答案为:6.4mol;0.2mol;
(6)令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2![]() 2H2O,
2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:x2y=1,x+y=3,解得x:y=7:2,
若氧气过量,则:y0.5x=1,x+y=3,解得x:y=4
故答案为:7:2 或4:5。

 阅读快车系列答案
阅读快车系列答案