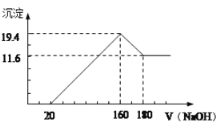
题目内容
【题目】(1)工农业生产和生活中常常进行分离或提纯,请选择相应的方法代号填入空白处:
a.过滤 B.蒸馏 C..萃取 d分液
①分离水和菜籽油的混合物 。②海水淡化 。
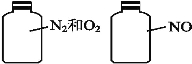
(2)如图,两瓶体积相等的气体,在同温、同压下,原子总数 (填“相等”、“不相等”),当两瓶气体质量相等时,N2和O2的体积比为 。
(3)下列物质所含分子数由多到少的顺序是 。(用A、B、C、D排序)
A.标准状况下33.6 L CO
B.所含电子为4 mol的H2
C.20 ℃时45 g H2O
D.常温下,0.5NA个CO2与0.5NA个CO的混合气体
(4)与50 mL 1mol·L-1 MgCl2溶液中的Cl-物质的量浓度相等的是
A.50 mL 1 mol·L-1 FeCl3溶液
B.25 mL 2 mol·L-1 CaCl2溶液
C.50 mL 2 mol·L-1 KCl溶液
(5)某状况下气体摩尔体积为Vm L/mol, 将a L NH3溶解于水中形成b mL氨水溶液,所得溶液的密度为ρ g/cm3,则氨水的溶质质量分数为 。
【答案】(1)①d ②b ;
(2)相等;1:1;
(3)C>B>A>D;(4)C;(5)![]()
【解析】
试题分析:(1)①水和菜籽油互不混溶,选用分液的方法分离,故选d;
② 海水淡化可以通过蒸馏的方法进行,故选b;
(2)根据阿伏伽德罗定律,同温、同压下,体积相等的气体含有相同数目的分子,因为涉及的分子均为双原子分子,原子总数液相等,当两瓶气体质量相等时,N2和O2的平均组成为NO,物质的量之比为1:1,体积比为,1:1,故答案为:相等;1:1;
(3)A.标准状况下33.6L氢气的物质的量为:![]() =1.5mol;B.氢气分子中含有2个电子,所含电子的物质的量为4mol的氢气的物质的量为2mol;C.20℃时45g H2O的物质的量为:
=1.5mol;B.氢气分子中含有2个电子,所含电子的物质的量为4mol的氢气的物质的量为2mol;C.20℃时45g H2O的物质的量为:![]() =2.5mol;D.常温下,0.5NA个CO2与0.5NA个CO的混合气体中含有0.5mol CO2和0.5molCO,总共含有1mol气体分子;分子数与分子的物质的量成正比,各物质的物质的量由大到小的顺序为:CBAD,故答案为:CBAD;
=2.5mol;D.常温下,0.5NA个CO2与0.5NA个CO的混合气体中含有0.5mol CO2和0.5molCO,总共含有1mol气体分子;分子数与分子的物质的量成正比,各物质的物质的量由大到小的顺序为:CBAD,故答案为:CBAD;
(4) 1mol·L-1 MgCl2溶液中的Cl-物质的量浓度为2mol/L,A.1 mol·L-1 FeCl3溶液中的Cl-物质的量浓度为3mol/L,错误;B.2 mol·L-1 CaCl2溶液中的Cl-物质的量浓度为4mol/L,错误;C.2 mol·L-1 KCl溶液中的Cl-物质的量浓度为2mol/L,正确;故答案为:C;
(5) a L NH3的物质的量为![]() =
=![]() mol,质量为
mol,质量为![]() mol×17g/mol=
mol×17g/mol=![]() g,氨水溶液的质量为b mL×ρ g/cm3=bρg,氨水的溶质质量分数为
g,氨水溶液的质量为b mL×ρ g/cm3=bρg,氨水的溶质质量分数为![]() ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() 。
。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案