题目内容
平衡问题是中学化学理论中的核心问题,请完成以下相关小题:(1)若在某温度下向恒压容器中投入反应物A、B,当反应A(g)+3B(g)
 2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为 mol,平衡常数K= ,恒温恒压时,再向此容器内通入1.8mol A,平衡将 (填“正向”、“逆向”或“不”)移动.
2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为 mol,平衡常数K= ,恒温恒压时,再向此容器内通入1.8mol A,平衡将 (填“正向”、“逆向”或“不”)移动.(2)已知Ksp(BaSO4)≈1×10-10,Ksp(BaCO3)≈5×10-9,则饱和:BaSO4溶液中c(SO42-)mol?L-1,向BaSO4悬浊液中逐渐加入Na2CO3固体至c(CO32-)= mol.L-1时,BaSO4开始向BaCO3沉淀转化.
(3)若25°C时某一元酸HA的电离平衡常数Ka=1×10-6,则相同温度下NaA的水溶液呈碱性的原因可用离子方程式表示为 ,相同物质的量浓度的HA和NaA两溶液等体积混合后,溶液显 性(±真“酸”、“碱”或“中”).
【答案】分析:(1)根据方程式A(g)+3B(g) 2C(g),结合C的物质的量的变化量△n(C),计算出△n(A),再利用n(A)初始=n(A)平衡+△n(A);
2C(g),结合C的物质的量的变化量△n(C),计算出△n(A),再利用n(A)初始=n(A)平衡+△n(A);
该反应平衡常数为k=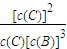 ,计算出平衡时各物质的浓度,将各物质的平衡浓度带入计算;
,计算出平衡时各物质的浓度,将各物质的平衡浓度带入计算;
计算出改变条件后各物质的浓度,再计算出浓度商,与平衡常数相比,判断平衡是否移动.
(2)根据Ksp(BaSO4)≈1×10-10计算出溶液中c(Ba2+),再根据Ksp(BaCO3)≈5×10-9计算.
(3)HA为弱酸,利用A-与水电离出的H+结合成HA使NaA的水溶液呈碱性;
根据HA的电离平衡常数,计算出H+水解平衡常数,由此比较电离与水解程度的相对大小,判断溶液的酸碱性.
解答:解:(1)达到平衡时,△n(C)=0.4mol,物质的量之比等于化学计量数之比,所以△n(A)= △n(C)=
△n(C)= ×0.4mol=0.2mol,故n(A)初始=n(A)平衡+△n(A)=1mol+0.2mol=1.2mol;
×0.4mol=0.2mol,故n(A)初始=n(A)平衡+△n(A)=1mol+0.2mol=1.2mol;
达到平衡时,c(A)=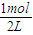 =0.5mol/L,c(B)=
=0.5mol/L,c(B)=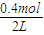 =0.2mol/L,c(C)=
=0.2mol/L,c(C)=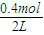 =0.2mol/L,该温度下,反应平衡常数为k=
=0.2mol/L,该温度下,反应平衡常数为k=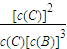 =
=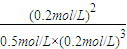 =10mol-2?L2;
=10mol-2?L2;
恒温恒压时,再向此容器内通入1.8mol A,假定平衡不移动,体积之比等于物质的量之比,令此时体积为VL,则:
2L:VL=(1mol+04mol+0.4mol):(2.8mol+0.4mol+0.4mol),解得V=4,此时各物质的浓度为c(A)=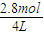 =0.7mol/L,c(B)=
=0.7mol/L,c(B)=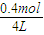 =0.1mol/L,c(C)=
=0.1mol/L,c(C)=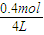 =0.1mol/L,浓度商Qc=
=0.1mol/L,浓度商Qc=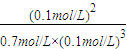 =14.3mol-2?L2,大于10mol-2?L2,所以平衡向逆反应进行.
=14.3mol-2?L2,大于10mol-2?L2,所以平衡向逆反应进行.
故答案为:1.2;10mol-2?L2;逆反应;
(2)溶液中c(Ba2+)=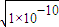 =10-5mol/L,所以c(CO32-)=
=10-5mol/L,所以c(CO32-)=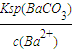 =
=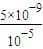 =5×10-4mol/L,故答案为:5×10-4;
=5×10-4mol/L,故答案为:5×10-4;
(3)HA为弱酸,HA的电离平衡常数Ka=1×10-6,A-与水电离出的H+结合成HA使NaA的水溶液呈碱性,水解方程式为A-+H2O?HA+OH-,其水解常数为Kh=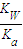 =
=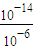 =10-8,小于HA的电离平衡常数Ka=1×10-6,电离大于水解程度,相同物质的量浓度的HA和NaA两溶液等体积混合后,浓度相等,所以溶液呈酸性.
=10-8,小于HA的电离平衡常数Ka=1×10-6,电离大于水解程度,相同物质的量浓度的HA和NaA两溶液等体积混合后,浓度相等,所以溶液呈酸性.
故答案为:A-+H2O?HA+OH-;酸性.
点评:主要考查有关平衡的定量计算分析等综合能力,难度较大,(3)中将电离与水解结合在一起,利用水解平衡常数与电离平衡常数判断溶液的酸碱性为易错点,难点,不能想当然的认为电离程度大于水解程度.
 2C(g),结合C的物质的量的变化量△n(C),计算出△n(A),再利用n(A)初始=n(A)平衡+△n(A);
2C(g),结合C的物质的量的变化量△n(C),计算出△n(A),再利用n(A)初始=n(A)平衡+△n(A);该反应平衡常数为k=
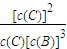 ,计算出平衡时各物质的浓度,将各物质的平衡浓度带入计算;
,计算出平衡时各物质的浓度,将各物质的平衡浓度带入计算;计算出改变条件后各物质的浓度,再计算出浓度商,与平衡常数相比,判断平衡是否移动.
(2)根据Ksp(BaSO4)≈1×10-10计算出溶液中c(Ba2+),再根据Ksp(BaCO3)≈5×10-9计算.
(3)HA为弱酸,利用A-与水电离出的H+结合成HA使NaA的水溶液呈碱性;
根据HA的电离平衡常数,计算出H+水解平衡常数,由此比较电离与水解程度的相对大小,判断溶液的酸碱性.
解答:解:(1)达到平衡时,△n(C)=0.4mol,物质的量之比等于化学计量数之比,所以△n(A)=
 △n(C)=
△n(C)= ×0.4mol=0.2mol,故n(A)初始=n(A)平衡+△n(A)=1mol+0.2mol=1.2mol;
×0.4mol=0.2mol,故n(A)初始=n(A)平衡+△n(A)=1mol+0.2mol=1.2mol;达到平衡时,c(A)=
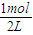 =0.5mol/L,c(B)=
=0.5mol/L,c(B)=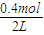 =0.2mol/L,c(C)=
=0.2mol/L,c(C)=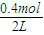 =0.2mol/L,该温度下,反应平衡常数为k=
=0.2mol/L,该温度下,反应平衡常数为k=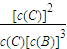 =
=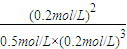 =10mol-2?L2;
=10mol-2?L2;恒温恒压时,再向此容器内通入1.8mol A,假定平衡不移动,体积之比等于物质的量之比,令此时体积为VL,则:
2L:VL=(1mol+04mol+0.4mol):(2.8mol+0.4mol+0.4mol),解得V=4,此时各物质的浓度为c(A)=
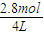 =0.7mol/L,c(B)=
=0.7mol/L,c(B)=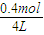 =0.1mol/L,c(C)=
=0.1mol/L,c(C)=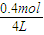 =0.1mol/L,浓度商Qc=
=0.1mol/L,浓度商Qc=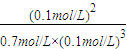 =14.3mol-2?L2,大于10mol-2?L2,所以平衡向逆反应进行.
=14.3mol-2?L2,大于10mol-2?L2,所以平衡向逆反应进行.故答案为:1.2;10mol-2?L2;逆反应;
(2)溶液中c(Ba2+)=
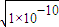 =10-5mol/L,所以c(CO32-)=
=10-5mol/L,所以c(CO32-)=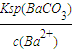 =
=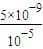 =5×10-4mol/L,故答案为:5×10-4;
=5×10-4mol/L,故答案为:5×10-4;(3)HA为弱酸,HA的电离平衡常数Ka=1×10-6,A-与水电离出的H+结合成HA使NaA的水溶液呈碱性,水解方程式为A-+H2O?HA+OH-,其水解常数为Kh=
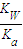 =
=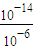 =10-8,小于HA的电离平衡常数Ka=1×10-6,电离大于水解程度,相同物质的量浓度的HA和NaA两溶液等体积混合后,浓度相等,所以溶液呈酸性.
=10-8,小于HA的电离平衡常数Ka=1×10-6,电离大于水解程度,相同物质的量浓度的HA和NaA两溶液等体积混合后,浓度相等,所以溶液呈酸性.故答案为:A-+H2O?HA+OH-;酸性.
点评:主要考查有关平衡的定量计算分析等综合能力,难度较大,(3)中将电离与水解结合在一起,利用水解平衡常数与电离平衡常数判断溶液的酸碱性为易错点,难点,不能想当然的认为电离程度大于水解程度.

练习册系列答案
相关题目
 2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为
2C(g)达到平衡时,测得容器中含有A 1mol B 0.4mol,C 0.4mol,此时容积为2L.则A的起始投入量为