题目内容
8.已知氯化铝溶液和碳酸钠溶液的浓度均为0.1mol/L,据此回答下列问题:(1)氯化铝溶液显酸性(选填“碱性”、“中性”或“酸性”),用离子方程式说明其原因Al3++3H2O?Al(OH)3+3H+;实验室若将100mL0.1mol/L的氯化铝溶液蒸干并灼烧至恒重,则所得固体质量为0.51g克.
(2)常温下,碳酸钠溶液的PH>7(选填“<”、“=”或“>”),因此常用于去除金属表面的油污.0.1mol/L碳酸钠溶液中各离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);向其中加入一定量0.1mol/L氯化铝溶液产生的现象是产生无色无味气体和白色沉淀,有关离子方程式为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑.
(3)工业上常用电解法冶炼金属铝,其原理用方程式表示为2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
分析 (1)氯化铝是强酸弱碱盐,铝离子水解溶液显酸性,实验室若将100mL0.1mol/L的氯化铝溶液蒸干并灼烧至恒重生成氧化铝,结合铝元素守恒计算;
(2)碳酸钠溶液中碳酸根离子水解溶液呈碱性,碳酸根离子分步水解;向其中加入一定量0.1mol/L氯化铝溶液,氯化铝和碳酸钠发生双水解生成氢氧化铝沉淀和二氧化碳;
(3)电解熔融氧化铝生成铝和氧气.
解答 解:(1)氯化铝是强酸弱碱盐,铝离子水解溶液显酸性,氯化铝是强酸弱碱盐,铝离子水解溶液显酸性,用离子方程式说明其原因:Al3++3H2O?Al(OH)3+3H+,实验室若将100mL0.1mol/L的氯化铝溶液蒸干并灼烧至恒重得到水解产物分解生成氧化铝,结合铝元素守恒计算,则所得固体氧化铝质量=0.1L×0.1mol/L×$\frac{1}{2}$×102g/mol=0.51g,
故答案为:酸性;Al3++3H2O?Al(OH)3+3H+; 0.51g;
(2)常温下,碳酸钠溶液中碳酸根离子水解溶液呈碱性,溶液的PH>7,碳酸钠溶液中碳酸根离子分步水解,溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),向其中加入一定量0.1mol/L氯化铝溶液,氯化铝和碳酸钠发生双水解生成氢氧化铝沉淀和二氧化碳,反应现象是产生无色无味气体和白色沉淀,反应的离子方程式为:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑,
故答案为:>; c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);产生无色无味气体和白色沉淀;3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑;
(3)工业上常用电解法冶炼金属铝是电解熔融氧化铝生成铝和氧气,反应的化学方程式为:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,
故答案为:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
点评 本题考查了盐类水解原理、溶液蒸干得到固体成分的判断依据、电解质溶液中离子浓度大小、盐类双水解等,掌握基础是解题关键,题目难度中等.

| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 分别用B、C表示反应的速率,其关系是:3υ(B)=2υ(C) | |
| C. | 2min末的反应速率υ(B)=0.3mol•L-1•min-1 | |
| D. | 气体的密度不再变化,则证明反应已经达到平衡状态 |
 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
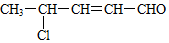 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 加成反应 | B. | 酯化反应 | C. | 氧化反应 | D. | 水解反应 |
| A. | 铜元素发生了氧化反应 | B. | 反应中只有O2得电子 | ||
| C. | 32gO2参与反应,转移电子4mol | D. | Cu2S既被氧化又被还原 |
| A. | H2O | B. | NaOH溶液 | C. | 盐酸 | D. | 石蕊试液 |
| A. | 食物放在冰箱中 | B. | 在月饼包装内放脱氧剂 | ||
| C. | 燃煤发电时用煤粉代替煤块 | D. | 橡胶制品中添加抑制剂 |
 异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )
异鼠李素的结构简式如图所示.当与等量该有机物反应时,最多消耗Br2、Na、NaOH的物质的量之比为( )| A. | 1:1:1 | B. | 4:4:3 | C. | 5:4:3 | D. | 3:5:1 |