��Ŀ����
��14�֣�������ѧ��Ӧ����ʽA+BX+Y+H2O����ش�
(1) ��AΪ������ˮ���Σ�B��ǿ�ʵ���ҳ��ô˷�Ӧ�Ʊ�����X��д���÷�Ӧ�Ļ�ѧ����ʽ �������������X�ķ����� ��
(2) ��AΪ��ɫ���壬Y�ǻ���ɫ���壬д��Y �ĵ���ʽ ���÷�Ӧ�����ӷ���ʽ �� ��������Yͨ��NaOH��Һ�м��ȷ�����Ӧ��������6.72L(��״��)Y����ʱ��ת��0.5mol���ӣ�д���÷�Ӧ�Ļ�ѧ����ʽ ��
(3) ��AΪ�������ʣ�B��ϡ���ᣬ��A��B�����ʵ���֮��Ϊ1:4���з�Ӧ��������ɫ����X��������������Ϊ����ɫ����A������Y��Һ�С�
��д���÷�Ӧ�Ļ�ѧ����ʽ ��
�ں�0.5molY����Һ�ܽ���һ����A������Һ�����ֽ��������ӵ����ʵ���ǡ����ȣ���ԭ��Y�� mol��
��ÿ�ո�2�֣�(1)2NH4Cl+Ca��OH��2 CaCl2+2H2O+2NH3������ʪ��ĺ�ɫʯ����ֽ���飬������������NH3������պŨ����IJ��������飬��ð���̣�����NH3��
(2) ��MnO2+4H++2Cl��
Mn2++Cl2��+2H2O��
6NaOH +3Cl2 NaClO3+5NaCl+3H2O
(3) �� Fe+4HNO3 NO��+Fe(NO3)3+2H2O ��0.2
����:��

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�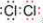
 X+Y+H2O����ش�
X+Y+H2O����ش�