题目内容
常见化学反应方程式A+B→X+Y+H2O.请回答:
(1)若A为红色金属单质,B是浓硫酸,写出该反应的化学方程式
(2)若A为黑色固体,Y是黄绿色气体,写出Y 的电子式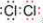
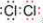 ,该反应的离子方程式是
,该反应的离子方程式是
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中.
①写出该反应的化学方程式
②含amolY的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的Y是
(1)若A为红色金属单质,B是浓硫酸,写出该反应的化学方程式
2H2SO4(浓)+Cu
CuSO4+2H2O+SO2↑
| ||
2H2SO4(浓)+Cu
CuSO4+2H2O+SO2↑
,检查其中气体产物X的方法是
| ||
将无色SO2通入品红溶液,若褪色,则证明是SO2
将无色SO2通入品红溶液,若褪色,则证明是SO2
.(2)若A为黑色固体,Y是黄绿色气体,写出Y 的电子式
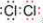
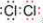
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.将气体Y通入NaOH溶液中加热发生反应,当消耗6.72L(标准状况)的气体时,转移0.5mol电子,写出该反应的化学方程式
| ||
6NaOH+3Cl2
NaClO3+5NaCl+3H2O
| ||
6NaOH+3Cl2
NaClO3+5NaCl+3H2O
.
| ||
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中.
①写出该反应的化学方程式
Fe+4HNO3=NO↑+Fe(NO3)3+2H2O
Fe+4HNO3=NO↑+Fe(NO3)3+2H2O
.②含amolY的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的Y是
0.2a
0.2a
mol.分析:(1)若A为红色金属单质,应为Cu,B是浓硫酸,二者在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫气体;
(2)若A为黑色固体,Y是黄绿色气体,应为二氧化锰和浓盐酸的反应,生成黄绿色气体为氯气;
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中,X为NO,同时说明金属为变价金属,应为Fe.
(2)若A为黑色固体,Y是黄绿色气体,应为二氧化锰和浓盐酸的反应,生成黄绿色气体为氯气;
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中,X为NO,同时说明金属为变价金属,应为Fe.
解答:解:(1)若A为红色金属单质,应为Cu,B是浓硫酸,二者在加热条件下发生氧化还原反应生成硫酸铜和二氧化硫气体,反应的方程式为2H2SO4(浓)+Cu
CuSO4+
2H2O+SO2↑,SO2具有漂白性,可使品红褪色,可将无色SO2通入品红溶液,若褪色,则证明是SO2,
故答案为:2H2SO4(浓)+Cu
CuSO4+2H2O+SO2↑;将无色SO2通入品红溶液,若褪色,则证明是SO2;
(2)若A为黑色固体,Y是黄绿色气体,应为二氧化锰和浓盐酸的反应,生成黄绿色气体为氯气,电子式为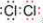 ,反应的离子方程式为MnO2+4H++2Cl-
,反应的离子方程式为MnO2+4H++2Cl-
Mn2++
Cl2↑+2H2O,将气体Cl2通入NaOH溶液中加热发生反应,当消耗6.72L(标准状况),即
=0.3mol的气体时,转移0.5mol电子,发生反应的化学方程式为
6NaOH+3Cl2
NaClO3+5NaCl+3H2O,
故答案为: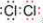 ;MnO2+4H++2Cl-
;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;6NaOH+3Cl2
NaClO3+5NaCl+3H2O;
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中,X为NO,同时说明金属为变价金属,应为Fe,发生反应的化学方程式为Fe+4HNO3=NO↑+Fe(NO3)3+2H2O,含amolFe(NO3)3的溶液溶解了一定量Fe后,若溶液中两种金属阳离子的物质的量恰好相等,发生反应为2Fe3++Fe=3Fe2+,可设参加反应的Fe为xmol,则参加反应的Fe3+为2xmol,则有3x=a-2x,x=0.2a,
故答案为:Fe+4HNO3=NO↑+Fe(NO3)3+2H2O;0.2a.
| ||
2H2O+SO2↑,SO2具有漂白性,可使品红褪色,可将无色SO2通入品红溶液,若褪色,则证明是SO2,
故答案为:2H2SO4(浓)+Cu
| ||
(2)若A为黑色固体,Y是黄绿色气体,应为二氧化锰和浓盐酸的反应,生成黄绿色气体为氯气,电子式为
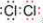 ,反应的离子方程式为MnO2+4H++2Cl-
,反应的离子方程式为MnO2+4H++2Cl-
| ||
Cl2↑+2H2O,将气体Cl2通入NaOH溶液中加热发生反应,当消耗6.72L(标准状况),即
| 6.72L |
| 22.4L/mol |
6NaOH+3Cl2
| ||
故答案为:
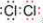 ;MnO2+4H++2Cl-
;MnO2+4H++2Cl-
| ||
| ||
(3)若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色.且A可溶于Y溶液中,X为NO,同时说明金属为变价金属,应为Fe,发生反应的化学方程式为Fe+4HNO3=NO↑+Fe(NO3)3+2H2O,含amolFe(NO3)3的溶液溶解了一定量Fe后,若溶液中两种金属阳离子的物质的量恰好相等,发生反应为2Fe3++Fe=3Fe2+,可设参加反应的Fe为xmol,则参加反应的Fe3+为2xmol,则有3x=a-2x,x=0.2a,
故答案为:Fe+4HNO3=NO↑+Fe(NO3)3+2H2O;0.2a.
点评:本题考查无机物的推断,题目难度中等,注意根据物质的颜色、状态等特点进行判断,学习中注意把握相关物质的性质.

练习册系列答案
相关题目
 X+Y+H2O。请回答:
X+Y+H2O。请回答: