题目内容
下列工业生产的主要反应原理不涉及氧化还原反应的是
| A.硝酸工业 | B.接触法制硫酸 | C.合成氨工业 | D.氨碱法制纯碱 |
D
试题分析:A、硝酸工业是利用氨气的催化氧化生成一氧化氮,一氧化氮被氧气氧化为二氧化氮,二氧化氮和水发生氧化还原反应生成硝酸,因此过程中的反应都是氧化还原反应,故A不符合题意;B、接触法制硫酸是利用黄铁矿燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸;前两步都是氧化还原反应,故B不符合题意;C、合成氨工业是利用分离空气得到的氮气和水煤气中生成的氢气的反应是氧化还原反应。氢气和氮气发生氧化还原反应生成氨气,故C不符合题意;D、氨碱法制纯碱,是向氨化的饱和食盐水中通入二氧化碳反应生成碳酸氢钠;反应过程中无元素化合价变化,不是氧化还原反应,故D符合,答案选D。

练习册系列答案
相关题目

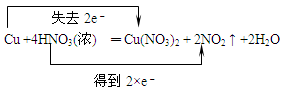


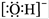
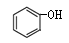 和
和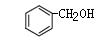 互为同系物
互为同系物
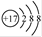
 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4铬酸钾溶液中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
Cr2O72-(橙色)+H2O通电后阳极区溶液由 变为 。原因是 。
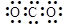
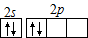

 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) 2CrO42-+2H+
2CrO42-+2H+ 2Al+Fe2O3
2Al+Fe2O3