��Ŀ����
����Ŀ��X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ��������������X��Zͬ���壬���γ����ӻ�����ZX��Y��Mͬ���壬���γ�MY2��MY3���ַ��ӡ��ش��������⣺
��1�� Y��Ԫ�����ڱ��е�λ��Ϊ_____________________________.
��2�� ����Ԫ�ص�����������Ӧ��ˮ����������ǿ����_____________________ (д��ѧʽ)���ǽ�����̬�⻯�ﻹԭ����ǿ����_________________(д��ѧʽ)��
��3�� Y��G�ĵ��ʻ���Ԫ��֮���γɵĻ��������ˮ����������__________________ (д�������������ʵĻ�ѧʽ))��
��4�� ZX�ĵ���ʽΪ_________________��ZX��ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪ_____________��
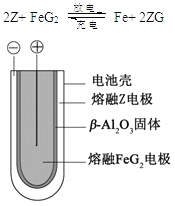
��5�� ����״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ����(װ��ʾ��ͼ����)���ŵ�ʱ����ص�������Ӧ
���𰸡���1��Y��2����VIA
��2��HclO4��H2S
��3��O3��Cl2��ClO2��ȡ����������ֶ��ɣ�
��4��![]() ��
��![]()
��5��![]()
�����������������X��Y��Z��M��G����Ԫ�ط������������ڣ���ԭ������������������X��HԪ�أ�X��Zͬ���壬���γ����ӻ�����ZX����Yԭ����������Yԭ������������Z��NaԪ�أ�Y��Mͬ���壬���γ�MY2��MY3���ַ��ӣ�����Y��OԪ�أ�M��SԪ�أ�G�Ƕ���������Ԫ�أ�����G��ClԪ�أ�������ϡ�����壩��
��1��Y��OԪ�أ�Oԭ����2�����Ӳ㣬����������Ϊ6�����ڵڶ����ڵ���A��.
�ʴ�Ϊ���ڶ����ڵ���A�壻
��2���ǽ���Ԫ�صķǽ�����Խǿ������Ӧ����ۺ����������Խǿ���⼸��Ԫ�طǽ�
������ǿ����ClԪ�أ���������ۺ������������ǿ���Ǹ�����HClO4���ǽ�����Խ������̬�⻯�ﻹԭ��Խǿ����ԭ����ǿ����̬�⻯�������� H2S��
�ʴ�Ϊ��HClO4��H2S��
��3��Y�ĵ���O3��G�ĵ���Cl2�������γɵ�ClO2������������
�ʴ�Ϊ��Cl2��O3��ClO2��ȡ����������ֶ��ɣ���
��4��ZXΪNaH���������ӻ���������������⸺���ӹ��ɣ�����ʽΪ![]() ��
��
Na��ˮ��Ӧ��������������������Ӧ��ѧ����ʽΪΪ��NaH+H2O=NaOH+H2����
�ʴ�Ϊ��![]() ��NaH+H2O=NaOH+H2����
��NaH+H2O=NaOH+H2����
��5������״̬�£�Z�ĵ��ʺ�FeG2����ɿɳ���أ���ط�ӦΪ��![]() �����Էŵ�ʱ����ص�������ӦΪ��Fe2++2e-=Fe��
�����Էŵ�ʱ����ص�������ӦΪ��Fe2++2e-=Fe��
�ʴ�Ϊ��Fe2++2e-=Fe��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�����Ŀ����2016����ɽ��ģ��[��ѧѡ��3���ʽṹ������]
��Ȼ���д��ڴ����Ľ���Ԫ�أ������ơ�þ����������ͭ���ڹ�ũҵ���������Ź㷺��Ӧ�á�
��1����д��Fe�Ļ�̬ԭ�Ӻ�������Ų�ʽ ��
��2������A��ԭ��ֻ��3�����Ӳ㣬���һ�����ĵ��������£�
�����ܣ�KJ/mol�� | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
��Aԭ�ӵļ۵����Ų�ʽΪ ��
��3���ϳɰ���ҵ�У�ԭ������N2��H2������CO��NH3�Ļ�������ڽ���ϳ���ǰ���ô��������ͭ��I����Һ������ԭ�������е�CO(Ac-����CH3COO-)���䷴Ӧ�ǣ�[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3CO]Ac[�����ʻ�������ͭ��I��] ��H<0
[Cu(NH3)3CO]Ac[�����ʻ�������ͭ��I��] ��H<0
��C��N��O����Ԫ�صĵ�һ��������С�����˳��Ϊ
�������[Cu(NH3)3CO]Ac����ԭ�ӵ���λ��Ϊ
����һ��������NH3��CO2�ܺϳ�����[CO(NH2)2]��������Cԭ����Nԭ�ӹ�����ӻ����ͷֱ�Ϊ ��1mol���ط����У��Ҽ�����ĿΪ NA��
��4��NaCl��MgO���������ӻ����NaCl���۵�Ϊ801.3����MgO���۵�ߴ�2800����������־����۵������Ҫԭ���� ��
��5����NH4��2SO4��NH4NO3�ȿ����P�ﳾ������������������NH4+�Ŀռ乹���� ������������������NO3-��Ϊ�ȵ�����ķ����� �����ѧʽ��
��6��ͭ�Ļ���������ܶ࣬��ͼ��������ͭ�ľ����ṹ����֪�������ⳤΪa cm�����⻯��ͭ�ܶȵļ���ʽΪ��= g/cm3.(��NA��ʾ����ӵ�����)

����Ŀ����ȥ�������������������ʣ�ѡ�õ��Լ���ȷ���ǣ� ��
ѡ�� | ���ʣ����ʣ� | �Լ� |
A | Al2O3��SiO2�� | NaOH��Һ |
B | FeCl2��Һ��FeCl3�� | Fe�� |
C | CO2��SO2�� | Na2CO3��Һ |
D | NaHCO3��Һ��Na2CO3�� | Ca��OH��2��Һ |





