题目内容
实验是化学研究的基础,下列关于各实验装置图的叙述中,错误的是( )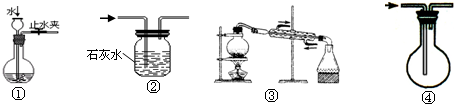

分析:A、检查装置的气密性装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡;
B、根据二氧化碳和一氧化碳的性质分析,二氧化碳是酸性氧化物能和碱反应;
C、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等;
D、根据N2和空气的密度可知,N2不能用排空气法收集.
B、根据二氧化碳和一氧化碳的性质分析,二氧化碳是酸性氧化物能和碱反应;
C、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等;
D、根据N2和空气的密度可知,N2不能用排空气法收集.
解答:解:A、用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好,故能检查装置气密性,故A正确;
B、二氧化碳是酸性氧化物,能和澄清石灰水反应生成碳酸钙白色沉淀,一氧化碳和澄清石灰水不反应,所以装置②可用于除去CO中混有的少量CO2,故B正确;
C、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,从海水中把盐分离出去,可以达到淡化海水的目的,所以装置③可用于从海水中得到淡水,故C正确;
D、N2的密度与空气的密度相近,所以不能采用排空气法收集,故D错误.
故选D.
B、二氧化碳是酸性氧化物,能和澄清石灰水反应生成碳酸钙白色沉淀,一氧化碳和澄清石灰水不反应,所以装置②可用于除去CO中混有的少量CO2,故B正确;
C、海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等,从海水中把盐分离出去,可以达到淡化海水的目的,所以装置③可用于从海水中得到淡水,故C正确;
D、N2的密度与空气的密度相近,所以不能采用排空气法收集,故D错误.
故选D.
点评:本题考查了实验装置正误的判断,难度不大,注意根据气体的密度、溶解性选取相应的收集方法.

练习册系列答案
相关题目
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )


| A、装置①常用于分离沸点不同的液体混合物 | B、装置②用于吸收氨气,能够防止倒吸 | C、以NH4Cl为原料,装置③可制备少量NH3 | D、装置④a口进气可收集Cl2、NO等气 |
实验是化学研究的基础.对下列实验的现象描述正确的是( )
 |
 |
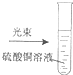 |
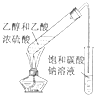 |
| ① | ② | ③ | ④ |
| A、实验①溶液褪色 |
| B、实验②溶液褪色 |
| C、实验③溶液中看到一条光亮的通路 |
| D、实验④饱和碳酸钠溶液下方出现油状液体 |
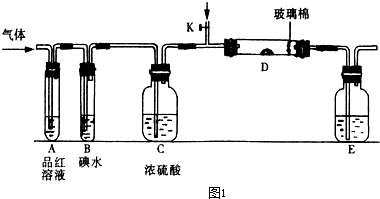
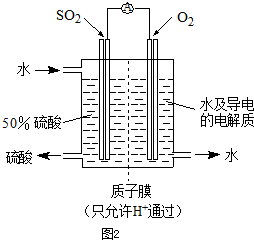
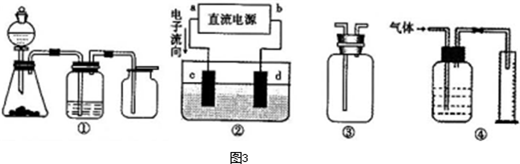
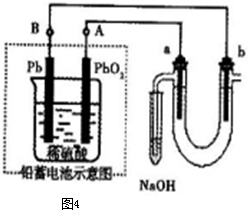
 (2012?济南一模)(1)实验是化学研究的基础,下列有关说法中,正确的是
(2012?济南一模)(1)实验是化学研究的基础,下列有关说法中,正确的是