题目内容
某课外活动小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净的氯气与氨气反应的装置.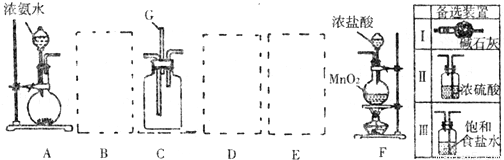
请回答下列问题:
(1)装置F中发生反应的离子方程式______ Mn2++C12↑+2H2O
【答案】分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;
(3)根据含有的杂质的性质选择合理的除杂装置;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;鉴定铵根离子是利用氨气的性质判断;
(5)根据氯气的化学性质,可以利用氢氧化钠溶液吸收尾气中的氯气.
解答:解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是:MnO2+4H++2C1- Mn2++C12↑+2H2O,
Mn2++C12↑+2H2O,
故答案为:MnO2+4H++2C1-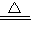 Mn2++C12↑+2H2O;
Mn2++C12↑+2H2O;
(2)利用物质溶解时放出热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、B.生石灰、E烧碱、F.氢氧化钠和氯化铵的混合物,都是碱性物质,且溶解于水时放出热量,C、二氧化硅不溶于水,D.五氧化二磷虽然溶于水时放热,但是酸性物质,
故选A、B、E、F;
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ,
故答案为:Ⅰ、Ⅱ、Ⅲ;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,根据化合价升降相等配平,反应的化学方程式是:8NH3+3C12=6NH4C1+N2;
通过检验氨气的方法来检验铵离子,检验方法为:取适量该白色固体与浓的氢氧化钠溶液共热,若产生能使湿润的石蕊试纸变蓝色的无色气体;则证明有NH4+存在,
故答案为:8NH3+3C12=6NH4C1+N2; 取适量该白色固体与浓的氢氧化钠溶液共热,若产生能使湿润的石蕊试纸变蓝色的无色气体;则证明有NH4+存在;
(5)氯气能够和氢氧化钠溶液反应,可以将尾气通过装有氢氧化钠溶液的洗气瓶后再排出,
故答案是:可将尾气通过装有氢氧化钠溶液的洗气瓶后再排出.
点评:本题考查了氨气和氯气的制取及性质,涉及了装置选择、化学方程式书写、尾气处理等知识,本题难度中等,注意干燥管干燥氨气时是大口进去小口出气.
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;
(3)根据含有的杂质的性质选择合理的除杂装置;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;鉴定铵根离子是利用氨气的性质判断;
(5)根据氯气的化学性质,可以利用氢氧化钠溶液吸收尾气中的氯气.
解答:解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是:MnO2+4H++2C1-
 Mn2++C12↑+2H2O,
Mn2++C12↑+2H2O,故答案为:MnO2+4H++2C1-
 Mn2++C12↑+2H2O;
Mn2++C12↑+2H2O;(2)利用物质溶解时放出热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、B.生石灰、E烧碱、F.氢氧化钠和氯化铵的混合物,都是碱性物质,且溶解于水时放出热量,C、二氧化硅不溶于水,D.五氧化二磷虽然溶于水时放热,但是酸性物质,
故选A、B、E、F;
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ,
故答案为:Ⅰ、Ⅱ、Ⅲ;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,根据化合价升降相等配平,反应的化学方程式是:8NH3+3C12=6NH4C1+N2;
通过检验氨气的方法来检验铵离子,检验方法为:取适量该白色固体与浓的氢氧化钠溶液共热,若产生能使湿润的石蕊试纸变蓝色的无色气体;则证明有NH4+存在,
故答案为:8NH3+3C12=6NH4C1+N2; 取适量该白色固体与浓的氢氧化钠溶液共热,若产生能使湿润的石蕊试纸变蓝色的无色气体;则证明有NH4+存在;
(5)氯气能够和氢氧化钠溶液反应,可以将尾气通过装有氢氧化钠溶液的洗气瓶后再排出,
故答案是:可将尾气通过装有氢氧化钠溶液的洗气瓶后再排出.
点评:本题考查了氨气和氯气的制取及性质,涉及了装置选择、化学方程式书写、尾气处理等知识,本题难度中等,注意干燥管干燥氨气时是大口进去小口出气.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目