题目内容
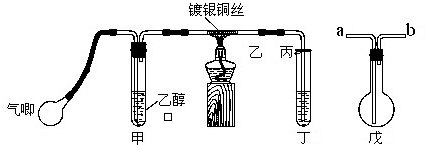
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管.请填写下列空白:
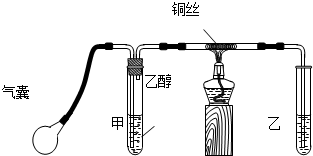
(1)甲装置常常浸在70~80℃的水浴中,目的是
(2)实验时,先加热玻璃管乙中的铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.
乙醇的催化氧化反应是
(3)将乙醇催化氧化后的产物与新制的Cu(OH)2混合,加热至沸腾,实验现象为

(1)甲装置常常浸在70~80℃的水浴中,目的是
适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流
适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流
.(2)实验时,先加热玻璃管乙中的铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.
乙醇的催化氧化反应是
放热
放热
反应(填“放热”或“吸热”),该反应的化学方程式为2CH3CH2OH+O2
2CH3CHO+H2O
| 铜 |
| △ |
2CH3CH2OH+O2
2CH3CHO+H2O
| 铜 |
| △ |
(3)将乙醇催化氧化后的产物与新制的Cu(OH)2混合,加热至沸腾,实验现象为
砖红色的沉淀
砖红色的沉淀
,写出反应方程式:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
| 加热 |
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
.简述配制新制的Cu(OH)2实验操作| 加热 |
在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成
在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成
.分析:(1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(2)该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
(3)将乙醛与新制的Cu(OH)2混合,加热至沸腾,产生砖红色的氧化亚铜沉淀;配制新制的Cu(OH)2实验操作:在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成;
(2)该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
(3)将乙醛与新制的Cu(OH)2混合,加热至沸腾,产生砖红色的氧化亚铜沉淀;配制新制的Cu(OH)2实验操作:在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成;
解答:解:(1)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,方程式为:2CH3CH2OH+O2
2CH3CHO+H2O;
故答案为:放热;2CH3CH2OH+O2
2CH3CHO+H2O;
(3)将乙醛与新制的Cu(OH)2混合,加热至沸腾,产生砖红色的氧化亚铜沉淀:CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O,配制新制的Cu(OH)2实验操作:在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成;
故答案为:砖红色的沉淀;CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O;在试管里加入5%的氢氧化钠溶液3mL,滴入3~4滴2%的硫酸铜溶液,振荡即成.
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,方程式为:2CH3CH2OH+O2
| 铜 |
| △ |
故答案为:放热;2CH3CH2OH+O2
| 铜 |
| △ |
(3)将乙醛与新制的Cu(OH)2混合,加热至沸腾,产生砖红色的氧化亚铜沉淀:CH3CHO+2Cu(OH)2
| 加热 |
故答案为:砖红色的沉淀;CH3CHO+2Cu(OH)2
| 加热 |
点评:本题考查了乙醇的催化氧化实验,可以根据课本知识来解决,注意新制的Cu(OH)2实验操作,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
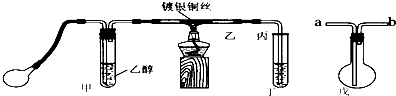 某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白:
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白: