题目内容
11.氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:(1)氮元素原子的L层电子数为5;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O;
(3)肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为O2+2H2O+4e-=4OH-.
分析 (1)氮原子的原子序数是7,氮原子有两个电子层,最外层有5个电子;
(2)氨气和次氯酸钠发生氧化反应生成肼、氯化钠和水;
(3)碱性燃料电池中,正极上氧化剂得电子发生还原反应,肼一空气燃料电池是一种碱性电池,该电池放电时,肼失电子被氧化发生负极反应,氧气得电子被还原发生正极反应.
解答 解:(1)氮原子核外有7个电子,K层有2个电子,L层有5个电子,故答案为:5;
(2)氨气和次氯酸钠发生氧化反应,次氯酸钠做氧化剂,生成肼、氯化钠和水,依据氧化还原反应的电子守恒和原子守恒写出该反应的化学方程式为::2NH3+NaClO=N2H4+NaCl+H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(3)肼、氧气碱性燃料电池中,肼所在电极为负极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-.
点评 本题考查了原子结构,化学方程式的书写,原电池的工作原理应用,电极反应的书写方法,题目难度不大,注意原电池正极上氧化剂得电子发生还原反应.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
1.在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.

图甲中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①浓盐酸挥发变稀,②反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱.
反应完毕经冷却后,②的试管中有大量晶体析出.图乙中符合该晶体溶解度曲线的是M(填写编号字母);
从②的试管中分离出该晶体的方法是过滤(填写实验操作名称).
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
19.(1)下表是A、B二种有机物的有关信息:
根据表中信息回答下列问题:
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式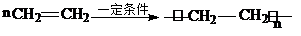 .
.
②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为: 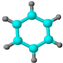 |
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
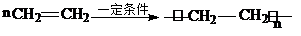 .
.②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为
 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
6.下列关于胶体的叙述中不正确的是( )
| A. | 丁达尔现象可用来区别胶体与溶液 | |
| B. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 | |
| C. | 胶体在一定条件下会发生聚沉 | |
| D. | 胶体粒子能通过半透膜,不能通过滤纸 |
16.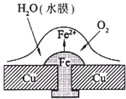 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
3.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 向蔗糖水解后所得溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 误食重金属盐而引起的中毒可服用大量豆浆或牛奶进行解救 |
1.如图是课外活动小组设计的用化学电源使LED灯发光的装置.下列说法错误的是( )


| A. | 铜片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将锌片换成铁片,电路中的电流方向不变 | |
| D. | 如果将稀硫酸换成柠檬汁,导线中不会有电子流动 |