题目内容
下列各组元素中,原子半径依次增大的是:( )
A. I、Br、Cl B. Al、Si、P C. O、S、Na D. C、N、B
C
解析试题分析:A. I、Br、Cl是同一主族的元素,由于原子核外电子层数逐渐减小,所以原子半径逐渐减小。错误。B. Al、Si、P是同一周期的元素,由于原子序数逐渐增大,因此原子半径逐渐减小。错误。C. O、S是同一主族的元素,由于原子核外电子层数S比O多,所以原子半径S>O;Na、S是同一周期的元素,由于所以序数S大于Na,原子序数越大,原子半径就越小,因此原子半径Na>S。故这三种元素的原子半径关系为:O< S <Na。正确。 D. 这三种元素是同一周期的元素。由于原子序数B< C<N,原子序数越大,原子半径就越小。故原子半径关系为B>C>N。 错误。
考点:考查元素周期表、元素周期律的应用的知识。

练习册系列答案
相关题目
核反应堆通常使用235U和239Pu作为原料,研究和开发核能可以减少对化石燃料的依赖。下列有关说法正确的是
| A.239Pu比235U原子核内多4个中子 |
| B.核反应堆中使用的重水与水互为同位素 |
| C.石油、天然气等化石燃料属于可再生能源 |
| D.合理使用核能可有效减少温室气体的排放 |
下列叙述中正确的是( )
| A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| B.除短周期外,其他周期均有18种元素 |
| C.副族元素中没有非金属元素 |
| D.碱金属元素是指IA族的所有元素 |
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说法中正确的是
| A.上述四种元素的原子半径大小为W<X<Y<Z |
| B.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
| C.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
下列关于d轨道的说法错误的是
| A.M层才开始出现d轨道 |
| B.d轨道最早出现在第4周期元素 |
| C.电子排布时,3d轨道能量高于4s轨道 |
| D.d轨道有10种空间伸展方向 |
下列说法中,正确的是
| A.第ⅠA族元素都比第ⅡA族元素金属性强 |
| B.只含有非金属元素的化合物可能是离子化合物 |
| C.只含有共价键的物质一定是共价化合物 |
| D.同主族元素原子半径越小越容易失去电子 |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是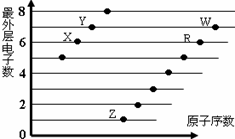
| A.该图体现出原子核外电子层呈现周期性变化 |
| B.原子半径:W>R>X |
| C.W的氢化物与R的氢化物水溶液的酸性比较,前者强于后者,可证明非金属性:R>W |
| D.R、Z形成的化合物中可能含有共价键 |
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径.X元素为( )
| A.Al | B.P | C.Ar | D.K |