题目内容
3.17g NH3和8g CH4的分子数之比为2:1,氢原子数之比为3:2,电子数之比为2:1.分析 根据n=$\frac{m}{M}$可知,分子数目之比等于物质的量之比;根据反应中含有H原子数目,计算含有H原子的个数之比;结合NH3和CH4的分子中所含电子数为10,来确定电子数之比,由此分析解答.
解答 解:17g NH3中n=$\frac{m}{M}$=$\frac{17g}{17g/mol}$=1mol,8g CH4的物质的量为:$\frac{8g}{16g/mol}$=0.5mol,所以分子数之比为:1mol:0.5mol=2:1,氢原子数之比为2×3:1×4=3:2,电子数之比为:2×10:1×10=2:1,故答案为:2:1;3:2;2:1.
点评 本题考查物质的量有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
3.下列性质的比较中,正确的是( )
| A. | 氧化性:S>Cl2 | B. | 金属性:K<Na | ||
| C. | 热稳定性:NaHCO3>Na2CO3 | D. | 酸性:HClO4>H2SO4 |
 D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源. 氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题:
氮化硼(NB)有六方氮化硼和立方氮化硼等不同结构,是一种重要的功能陶瓷材料.请回答下列问题: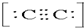 2-.
2-. 在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题:
在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间 t(min)的变化曲线如图所示,回答下列问题: