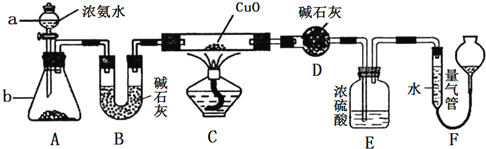
题目内容
【题目】以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。
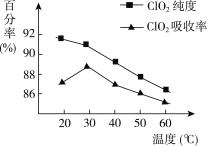
请回答下列问题:
(1)据图可知,反应时需要控制的适宜温度是________ ℃,达到此要求采取的适宜措施是________。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式:____________________________________。
【答案】30水浴加热(或水浴控制恒温)15ClO3-+FeS2+14H+=15ClO2↑+Fe3++7H2O+2SO42-
【解析】
(1)依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上;控制100°C以下的 温度需要用水浴加热;
(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,依据原子守恒,电子守恒和电荷守恒配平书写离子方程式;
(1)ClO2气体的纯度,且会影响ClO2的吸收率,依据图象分析温度再30°C时ClO2的吸收率最大纯度90%以上,控制100°C以下的温度需要用水浴加热;
(2)用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,氯酸跟离子在酸溶液中具有强氧化性,氧化FeS2为硫酸铁和硫酸,本身被还原为反应的离子方程式为ClO2;结合原子守恒、电子守恒配平写出离子方程式为:15ClO3-+FeS2+14H+═15ClO2+Fe3++7H2O+2SO42-;

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目