��Ŀ����
����Ŀ����1����֪��H2(g)+ Cl2(g) �T 2HCl(g) ��H=��184.6 kJmol��1��ӦHCl(g) �T1/2 H2(g) +1/2 Cl2(g)����HΪ_______��
��2����N2��H2�ϳ�1molNH3ʱ�ɷų�46.2kJ/mol�����������ֲ��ϲ��N��N���ļ�����948.9kJ/mol��H-H���ļ�����436.0kJ/mol����N-H���ļ�����_______kJ/mol��
��3���ڻ�ҩ���й��Ŵ����Ĵ���֮һ���䱬ը���Ȼ�ѧ����ʽΪ��
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ��H= x kJ��mol��1
��֪̼��ȼ������H1= a kJ��mol��1
S(s)+2K(s)==K2S(s) ��H2= b kJ��mol��1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ��H3= c kJ��mol��1 ��xΪ_______kJ/mol
��4������ƽ�����ʢ��ǿ��ԭ��Һ̬����N2H4����ǿ������Һ̬�������⡣����0.4molҺ̬�º�0.8mol H2O2��Ϸ�Ӧ�����ɵ�����ˮ�������ų�256.7kJ������(�൱��25����101 kPa�²�õ�����)����Ӧ���Ȼ�ѧ����ʽΪ_________________________________��
���𰸡� ��H=+92.3kJmol��1 391.55 ��3a+b-c�� N2H4(l) + 2H2O2 (l) = N2(g) + 4H2O(g) ��H=-641.75kJmol��1
����������1�������Ȼ�ѧ����ʽ����дԭ��ͷ�������֪��H2(g)+ Cl2(g) �T 2HCl(g) ��H=��184.6 kJmol��1���ı䷴Ӧ�����ʱ��Ϊ��ֵ������������2���ʱ�Ҳ����2���õ��Ȼ�ѧ����ʽΪ��HCl(g) �T1/2 H2(g) +1/2 Cl2(g)����HΪ+92.3kJmol��1 ����2��N2��H2�ϳ�NH3�ķ���ʽΪ��N2+3H2![]() 2NH3����N2��H2�ϳ�1molNH3ʱ�ɷų�������Ϊ46.2kJ��mol��1����Ӧ�ġ�H=-2��46.2=-92.4kJ��mol��1��1molN2��3molH2��Ӧ���ѻ�ѧ����Ҫ���յ�����Ϊ��1mol��948.9kJ��mol��1+3��436.0kJ��mol��1=2256.9kJ��N-H���ļ���Ϊx���γ�2molNH3��Ҫ�γ�6molN-H�������γ�6molN-H���ų�������Ϊ6x����2256.9-6��x=-92.4kJ��mol��1�����x=391.55kJ��mol��1����3��̼��ȼ���ȡ�H1=a kJ��mol��1�����Ȼ�ѧ����ʽΪC��s��+O2��g��=CO2��g����H1=a kJ��mol��11�٣�S��s��+2K��s���TK2S��s����H2=b kJ��mol��1�ڣ�2K��s��+N2��g��+3O2��g���T2KNO3��s����H3=c kJ��mol��1�ۣ�������ʽ3��+��-�۵�S��s��+2KNO3��s��+3C��s���TK2S��s��+N2��g��+3CO2��g������H3=��3a+b-c��kJ��mol��1 �� (4)��Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O��0.4molҺ̬�·ų�256.7KJ����������1molҺ̬�·ų�������Ϊ256.7kJ/0.4mol=641.75kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2H4(l) + 2H2O2 (l) = N2(g) + 4H2O(g) ��H=-641.75kJmol��1��
2NH3����N2��H2�ϳ�1molNH3ʱ�ɷų�������Ϊ46.2kJ��mol��1����Ӧ�ġ�H=-2��46.2=-92.4kJ��mol��1��1molN2��3molH2��Ӧ���ѻ�ѧ����Ҫ���յ�����Ϊ��1mol��948.9kJ��mol��1+3��436.0kJ��mol��1=2256.9kJ��N-H���ļ���Ϊx���γ�2molNH3��Ҫ�γ�6molN-H�������γ�6molN-H���ų�������Ϊ6x����2256.9-6��x=-92.4kJ��mol��1�����x=391.55kJ��mol��1����3��̼��ȼ���ȡ�H1=a kJ��mol��1�����Ȼ�ѧ����ʽΪC��s��+O2��g��=CO2��g����H1=a kJ��mol��11�٣�S��s��+2K��s���TK2S��s����H2=b kJ��mol��1�ڣ�2K��s��+N2��g��+3O2��g���T2KNO3��s����H3=c kJ��mol��1�ۣ�������ʽ3��+��-�۵�S��s��+2KNO3��s��+3C��s���TK2S��s��+N2��g��+3CO2��g������H3=��3a+b-c��kJ��mol��1 �� (4)��Ӧ����ʽΪ��N2H4+2H2O2=N2+4H2O��0.4molҺ̬�·ų�256.7KJ����������1molҺ̬�·ų�������Ϊ256.7kJ/0.4mol=641.75kJ����Ӧ���Ȼ�ѧ����ʽΪ��N2H4(l) + 2H2O2 (l) = N2(g) + 4H2O(g) ��H=-641.75kJmol��1��

 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�����Ŀ������ͼ��ʾ��װ���У���ƿ�г�����������a�����ι��е�Һ�強����ƿ�ڣ���������ƿ��Ȼ����ɼ�f���ձ��е�Һ��b����Ȫ״��������ռ���������ƿ���±������г��� a��b���ʲ�����Ҫ�����
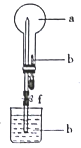
a������������ | b(Һ���� | |
A | NO2 | ˮ |
B | SO2 | �������Ը��������Һ |
C | Cl2 | ����NaOH��Һ |
D | NH3 | 2 mol/L.���� |
A. A B. B C. C D. D