题目内容
向含有NaBr 、KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是( )
| A.NaCl 和KI | B.NaCl、KCl和I2 | C.KCl和NaBr | D.KCl和NaCl |
D
解析试题分析:因Cl2的氧化性大于Br2、I2,所以Cl2能把溶液中的B r–、I–氧化,发生反应:2NaBr+Cl2=2NaCl+Br2、2KI+Cl2=2KCl+I2,通入过量的Cl2后,溶液中存在KCl、NaCl、Br2、I2,而Br2挥发性强,I2易升华变为气体,所以将溶液蒸干并灼烧,最后剩下固体物质是KCl、NaCl。故选D。
考点:考查氯气的化学性质,Br2的挥发性和I2易升华的性质。

练习册系列答案
相关题目
如图:A处通入氯气,关闭B阀时,C处湿润红色布条无变化,打开B阀时,C处湿润的红色布条褪色。则D中可以盛放足量的 ( )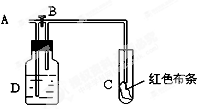
| A.浓硫酸 | B.氢氧化钠溶液 | C.水 | D.饱和食盐水 |
试管中充满某气体后倒立于盛水的水槽中,试管中立即充满液体,结果如图所示,该试管中原来所装的气体可能是( )
| A.CO2 | B.NO | C.NH3 | D.Cl2 |
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
| A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性) |
| B.在加热条件下铜与浓硫酸反应(氧化性、酸性) |
| C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) |
| D.浓硫酸可用来干燥某些气体(不挥发性) |
单晶硅是制作电子集成电路的基础材料。科学家预计,到2014年一个电脑芯片上将会集成100亿个晶体管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为 :
①SiO2 + 2C Si + 2CO
Si + 2CO
②Si + 2Cl2 SiCl4
SiCl4
③SiCl4 + 2H2 Si + 4HCl
Si + 4HCl
其中,反应①和③属于
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应o |
在下列用途或反应中,硫酸表现出的性质为:
| A.高沸点性; | B.酸性; | C.吸水性; | D.脱水性;(E)强氧化性。试用字母填空: |
(3)将浓硫酸加到浓盐酸中产生白雾:__________;
(4)浓硫酸可使湿润的蓝色石蕊试纸先变红,后变黑:______________。
用如图所示装置进行实验,下列对实验现象的解释不合理的是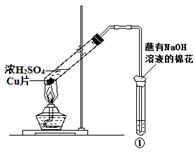
| | ①中试剂 | ①中现象 | 解 释 |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
下列有关氯气的叙述,不正确的是( )
| A.氯气是一种黄绿色气体 |
| B.氯气、液氯、氯水是同一种物质 |
| C.氯气能溶于水 |
| D.氯气是一种有毒气体 |
Na2O2、Cl2和SO2均能使品红溶液褪色(NA为阿伏加德罗常数的值)。下列说法正确的是
| A.Na2O2、Cl2、SO2使品红溶液褪色的原理相同 |
| B.标准状况下,1 mol Na2O2和22.4LCO2反应,转移电子数目为NA |
| C.等物质的量的Cl2和SO2同时通入品红溶液中,品红褪色更快 |
| D.在Na2O2中阴阳离子所含的电子数目相等 |