题目内容
(2009?福建)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为
(2)流程乙加入烧碱后生成SiO32-的离子方程式为
(3)验证滤液B含Fe3+,可取少量滤液并加入
(4)滤液E、K中溶质的主要成份是
(5)已知298K时,Mg(OH)2的容度积常数KSP=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.(2)流程乙加入烧碱后生成SiO32-的离子方程式为
SiO2+2OH-═SiO32-+H2O
SiO2+2OH-═SiO32-+H2O
.(3)验证滤液B含Fe3+,可取少量滤液并加入
硫氰化钾(或苯酚溶液、氢氧化钠溶液等)
硫氰化钾(或苯酚溶液、氢氧化钠溶液等)
(填试剂名称).(4)滤液E、K中溶质的主要成份是
NaHCO3
NaHCO3
(填化学式),写出该溶液的一种用途制纯碱(或做发酵粉)
制纯碱(或做发酵粉)
(5)已知298K时,Mg(OH)2的容度积常数KSP=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的c(Mg2+)=
5.6×10-10mol/L
5.6×10-10mol/L
.分析:(1)与HCl反应生成Al3+,应为铝土矿中Al2O3;
(2)SiO2可以溶于NaOH中生成Na2SiO3,写出离子方程式;
(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等;
(4)生成E、K时,CO2均是过量的,故应生成NaHCO3;
(5)Ksp=c(Mg2+)?c2(OH-),c(Mg2+)=
=5.6×10-10mol/L.
(2)SiO2可以溶于NaOH中生成Na2SiO3,写出离子方程式;
(3)检验Fe3+的特征反应很多,如与KSCN显血红色,与苯酚显紫色,与OH-显红褐色沉淀等;
(4)生成E、K时,CO2均是过量的,故应生成NaHCO3;
(5)Ksp=c(Mg2+)?c2(OH-),c(Mg2+)=
| 5.6×10-12 |
| 0.12 |
解答:解:(1)流程甲加入盐酸,反应生成铝离子的物质为铝土矿中的氧化铝,反应的化学方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:(1)Al2O3+6H+═2Al3++3H2O;
(2)流程乙加入过量的氢氧化钠,与氧化铝反应生成偏铝酸钠,与二氧化硅反应生成硅酸钠,生成SiO32-的离子方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(3)流程甲加入盐酸,生成氯化铁、氯化镁、氯化铝,要检验滤液B中含有铁离子,方法很多,如可加入硫氰化钾,溶液为血红色,与苯酚显紫色,与碱反应生成氢氧化铁红褐色沉淀,都能证明滤液B中含有铁离子,故答案为:硫氰化钾(或苯酚溶液、氢氧化钠溶液等合理答案);
(4)滤液B中加入过量氢氧化钠,生成氢氧化铁沉淀、氢氧化镁沉淀和偏铝酸钠;过滤,滤液D中含有偏铝酸钠、氯化钠和过量的氢氧化钠,向滤液D中通入过量二氧化碳,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,氢氧化钠和过量的二氧化碳反应生成碳酸氢钠;过滤,滤液E中溶质的主要成分为碳酸氢钠;滤液Y中通入过量二氧化碳,硅酸钠反应生成硅酸,偏铝酸钠生成氢氧化铝,过量的氢氧化钠和过量的二氧化碳反应生成碳酸氢钠;过滤,滤液K中溶质的主要成分为碳酸氢钠;故应填碳酸氢钠;碳酸氢钠的用途很多,如制纯碱或做发酵粉等;故答案为:NaHCO3;制纯碱(或做发酵粉);
(5)已知滤液B中加入一定量的烧碱达到沉淀溶液平衡时pH=13.00,则c(H+)=1×10-13mol/L,c(OH-)=
=0.1mol/L,
Mg(OH)2的容度积常数KSP=c(Mg2+)?c2(OH-)=5.6×10-12,c(Mg2+)=
=5.6×10-10mol/L.
故答案为:5.6×10-10mol/L.
(2)流程乙加入过量的氢氧化钠,与氧化铝反应生成偏铝酸钠,与二氧化硅反应生成硅酸钠,生成SiO32-的离子方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(3)流程甲加入盐酸,生成氯化铁、氯化镁、氯化铝,要检验滤液B中含有铁离子,方法很多,如可加入硫氰化钾,溶液为血红色,与苯酚显紫色,与碱反应生成氢氧化铁红褐色沉淀,都能证明滤液B中含有铁离子,故答案为:硫氰化钾(或苯酚溶液、氢氧化钠溶液等合理答案);
(4)滤液B中加入过量氢氧化钠,生成氢氧化铁沉淀、氢氧化镁沉淀和偏铝酸钠;过滤,滤液D中含有偏铝酸钠、氯化钠和过量的氢氧化钠,向滤液D中通入过量二氧化碳,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,氢氧化钠和过量的二氧化碳反应生成碳酸氢钠;过滤,滤液E中溶质的主要成分为碳酸氢钠;滤液Y中通入过量二氧化碳,硅酸钠反应生成硅酸,偏铝酸钠生成氢氧化铝,过量的氢氧化钠和过量的二氧化碳反应生成碳酸氢钠;过滤,滤液K中溶质的主要成分为碳酸氢钠;故应填碳酸氢钠;碳酸氢钠的用途很多,如制纯碱或做发酵粉等;故答案为:NaHCO3;制纯碱(或做发酵粉);
(5)已知滤液B中加入一定量的烧碱达到沉淀溶液平衡时pH=13.00,则c(H+)=1×10-13mol/L,c(OH-)=
| 1×10-14 |
| 1×10-13 |
Mg(OH)2的容度积常数KSP=c(Mg2+)?c2(OH-)=5.6×10-12,c(Mg2+)=
| 5.6×10-12 |
| 0.12 |
故答案为:5.6×10-10mol/L.
点评:化学实验、化学与技术、铝土矿中氧化铝提取的工艺流程综合考查,要注意平常知识的积累.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
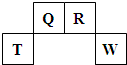 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团).

 +NaHCO3→
+NaHCO3→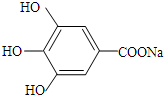 +H2O+CO2↑
+H2O+CO2↑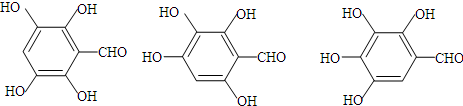 (写出上述3个结构简式中的任意2个即可)
(写出上述3个结构简式中的任意2个即可)