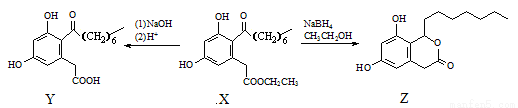
题目内容
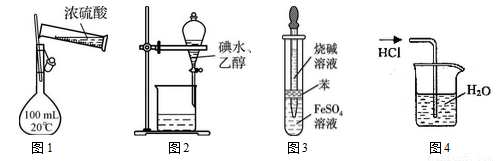
(18分)绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.如图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

查询资料,得有关物质的数据如下:
25℃时 | pH值 | 25℃时 | pH值 |
饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
(1)写出Fe和Fe2O3在硫酸溶液中发生反应的离子方程式为____、 ______ 、 __________;
(2)操作II中,通入硫化氢至饱和的目的是:①除去溶液中的Sn2+离子;②_________;③在溶液中用硫酸酸化至pH=2的目的是___________.
(3)操作IV的顺序依次为_____________、____________、过滤洗涤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___________.
(5)常温下,Ksp[Fe(OH)2]=1.64×10-14,则求得反应:Fe2++2H2O Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
Fe(OH)2+2H+的平衡常数为:_______________(保留1位小数);
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
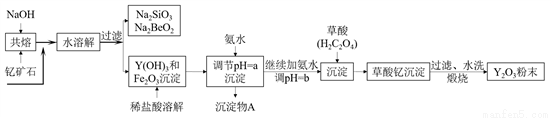
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
①最好选用盐酸和__________两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式__________。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在__________范围内;继续加氨水调节pH=b发生反应的离子方程式为__________;检验Fe3+是否沉淀完全的操作方法是__________。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式__________。



 D. CCl4的比例模型:
D. CCl4的比例模型: