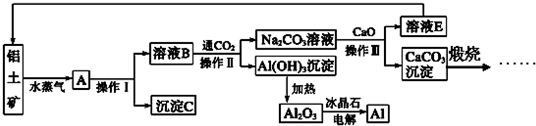
题目内容
请回答下列问题:(1)配平下列离子方程式:
| O | n- 4 |
(2)已知反应中ClO-与OH-的物质的量之比为3:4,则n=
(3)根据以上知识,推测Fe
| O | n- 4 |
A.O2 B.SO2 C.H2S D.HClO.
分析:(1)令Fe(OH)3计量数为1,设ClO-计量数为x,OH-计量数为y,利用原子守恒,则FeO4n-计量数为1,Cl-计量数为x,根据电荷守恒x+y=n+x,所以y=n,即OH-═的计量数为n,再根据氢原子守恒得H2O6+n=的计量数为
,再根据氧原子守恒:3+x+n=4+
,则x=
;
(2)ClO-与OH-的物质的量之比为3:4,即
=
,所以n=2;根据氯元素化合价变化分析;
(3)FeO4n-具有强氧化性.
| 3+n |
| 2 |
| 3+n |
| 2 |
| 5-n |
| 2 |
(2)ClO-与OH-的物质的量之比为3:4,即
| 5-n |
| 2n |
| 3 |
| 4 |
(3)FeO4n-具有强氧化性.
解答:解:(1)令Fe(OH)3计量数为1,设ClO-计量数为x,OH-计量数为y,利用原子守恒,则FeO4n-计量数为1,Cl-计量数为x,根据电荷守恒x+y=n+x,所以y=n,即OH-═的计量数为n,再根据氢原子守恒得H2O6+n=的计量数为
,再根据氧原子守恒:3+x+n=4+
,则x=
,
则化学方程式为:Fe(OH)3+
ClO-+n OH-═FeO4n-+
Cl-+
H2O,把方程式左右两边乘以2,可得2Fe(OH)3+(5-n)ClO-+2nOH-═2FeO4n-+(5-n)Cl-+(3+n) H2O,
故答案为:2;(5-n);2n;2;(5-n);(3+n);
(2)ClO-与OH-的物质的量之比为3:4,即
=
,所以n=2;氯元素化合价从+1价降低到-1价,失去2个电子,因此生成3mol Cl-转移6mol电子,
故答案为:2;6mol;
(3)FeO4n-具有强氧化性,SO2 和H2S具有还原性,能发生氧化还原反应,故答案为:BC.
| 3+n |
| 2 |
| 3+n |
| 2 |
| 5-n |
| 2 |
则化学方程式为:Fe(OH)3+
| 5-n |
| 2 |
| 5-n |
| 2 |
| 3+n |
| 2 |
故答案为:2;(5-n);2n;2;(5-n);(3+n);
(2)ClO-与OH-的物质的量之比为3:4,即
| 5-n |
| 2n |
| 3 |
| 4 |
故答案为:2;6mol;
(3)FeO4n-具有强氧化性,SO2 和H2S具有还原性,能发生氧化还原反应,故答案为:BC.
点评:本题考查了氧化还原方程式的配平,电子转移等难度较大,配平方程式时要注意利用原子守恒、电荷守恒和得失电子守恒.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
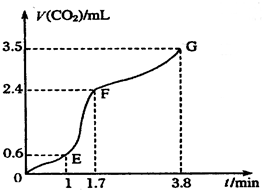 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: