题目内容
【题目】相同温度下,根据三种酸的电离常数,下列判断正确的是( )

A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol/L HX溶液的电离常数大于0.1 mol/L HX
【答案】B
【解析】A、按照HX、HY、HZ的顺序,三种酸的电离常数依次增大,说明三种酸依次增强,即HX<HY<HZ,所以A错误;B、根据较强的酸可以置换出较弱的酸的原则,B是正确;C、根据盐类水解的原理,越弱越水解,则相同温度下,0.1 mol/L的NaX、NaY、NaZ溶液,水解程度由强到弱的顺序为NaX>NaY>NaZ,所以它们溶液的pH依次减小,即NaZ溶液pH最小,故C错误;D、电离平衡常数只与弱电解质的性质和温度有关,在相同温度下,不同浓度的HX溶液的电离平衡常数是相同的,所以D错误。本题正确答案为B。

【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,少量C及SiO2)为原料制备的流程如下:
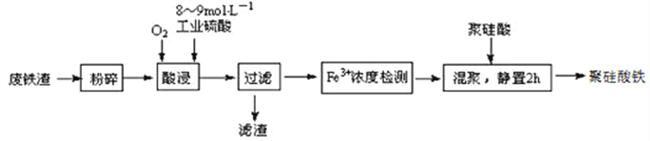
已知:在一定温度下酸浸时Fe3+在pH=2开始沉淀,pH=3.7沉淀完全
(1)废铁渣进行“粉碎”的目的是___________________________________________________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的影响如下表所示:
温度℃ | 40 | 60 | 80 | 100 | 120 |
铁浸取率 | 50 | 62 | 80 | 95 | 85 |
①请写出酸浸过程中Fe3O4发生的离子反应方程式__________________________________。
②硫酸酸浸时应控制溶液的pH____________,其原因是_________________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是___________________。
(3)上述过滤步骤的滤液的主要成分为____________(填化学式)。
(4)Fe3+浓度定量检则,是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为____________。





