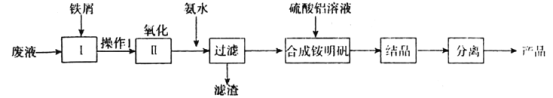
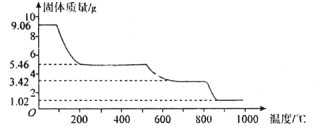
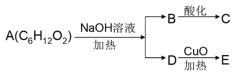
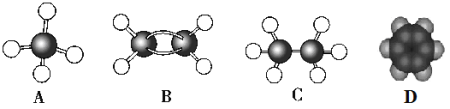
题目内容
【题目】实验室中用足量的二氧化锰和含有4 mol氯化氢的浓盐酸充分反应制氯气,下列说法正确的是( )
A.该实验中共消耗1 mol 二氧化锰,生成1 mol氯气
B.为了除去氯气中混有的杂质气体,可以依次通过饱和食盐水和碱石灰
C.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
D.氯气可以用向上排空气法或排水法收集
【答案】C
【解析】
A. MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,该反应需用浓盐酸,反应进行到一定程度后,盐酸浓度降低,反应停止,盐酸的消耗量不够4mol,生成的氯气少于1 mol,消耗的二氧化锰也不足1 mol,故A不正确;
MnCl2+Cl2↑+2H2O,该反应需用浓盐酸,反应进行到一定程度后,盐酸浓度降低,反应停止,盐酸的消耗量不够4mol,生成的氯气少于1 mol,消耗的二氧化锰也不足1 mol,故A不正确;
B. 碱石灰的成分是氧化钙和氢氧化钠,氯气可以与之发生反应,不能用碱石灰干燥氯气,故B不正确;
C. 在反应中二氧化锰中锰元素的价态降低,发生还原反应,作氧化剂,浓盐酸中氯元素价态升高,发生氧化反应,作还原剂,故C正确;
D. 氯气可溶于水,不能用排水法收集,但可以用排饱和食盐水的方法收集,不过不能收集到干燥的氯气,故D不正确。
正确答案选C。

练习册系列答案
相关题目
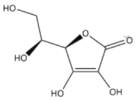
【题目】维生素C,结构简式如下图。可用碘量法测定含量。取2片维生素C片剂,溶于蒸馏水,定容至250mL,取50mL,用0.0l0mol/LI2标准液滴定至终点,重复实验,数据如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 1.00 | 25.98 |
2 | 1.24 | 25.36 |
3 | 1.38 | 26.40 |
已知:维生素C与I2按等物质的量恰好反应。
(1)该维生素C片溶液中维生素C的浓度为___mg/L。
(2)移取80mL橙汁于锥形瓶中,滴入lmL盐酸调节酸度,用0.010mol/LI2的标准溶液滴定至终点,消耗标准液10.12mL,则橙汁中维生素C的含量为____mg/L。简要写出计算过程。