题目内容
9.由Na2SO4和NaNO3组成的混合物184.5g溶于水配成1L溶液,此时溶液中Na+的浓度为2.5mol/L,则原混合物中NaNO3的质量为( )| A. | 42.5g | B. | 85g | C. | 25.5g | D. | 51g |
分析 根据n=nM计算钠离子物质的量,再根据总质量、钠离子总物质的量列方程计算Na2SO4、NaNO3各自物质的量,根据m=nM计算NaNO3的质量.
解答 解:溶液中Na+的物质的量为1L×2.5mol/L=2.5mol,
设Na2SO4、NaNO3的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{2x+y=2.5}\\{142x+85y=184.5}\end{array}\right.$
解得x=1、y=0.5
故NaNO3的质量为0.5mol×85g/mol=42.5g,
故选:A.
点评 本题考查混合物有关计算,比较基础,旨在考查学生对基础知识的巩固.

练习册系列答案
相关题目
19.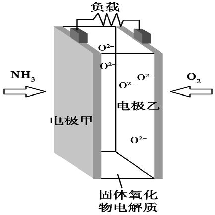 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为4NH3+5O2═4NO+6H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
4.用惰性电极电解2L 1mol•L-1的硫酸铜溶液,在电路中通过0.5mol电子后,将电源反接,电路中又通过1mol电子,此时溶液中c(H+)是(设溶液体积不变)( )
| A. | 1.5 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.75 mol•L-1 | D. | 0.25 mol•L-1 |
14.下列实验操作符合安全要求的是( )
| A. |  | B. |  | C. |  | D. |  |
1.下列说法中正确的是( )
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 物质的量是国际单位制中七个基本单位之一 | |
| C. | 阿伏加德罗常数是0.012kg 12C中含有的碳原子数目 | |
| D. | 标准状况下,1molH2O所占的体积为22.4L |
18.下列说法不正确是( )
| A. | 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用胶头滴管,逐滴加入至刻度 | |
| B. | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| C. | N2O5在四氯化碳溶液中分解为NO2和O2,可用分光光度计测定其化学反应速率 | |
| D. | 物质的分离提纯方法之一为“筛分:如胶体--半透膜法分离提纯;悬浊液--过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的筛子 |
19.下列关于生活中的现象及仪器的使用的说法不正确的是( )
| A. | “酸可除锈”、“纯碱溶液可去油污”都发生了化学变化 | |
| B. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注入人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| C. | 托盘天平称量药品时,都应垫上滤纸称量 | |
| D. | 滴定管以及容量瓶在使用前需检查是否漏水 |