题目内容
饱和一元醇A和B,B分子中碳原子比A多1,取A、B的混合物4.8 g,与足量的金属钠反应,产生标准状况下H2 1.344 L。试确定A和B的结构简式,并计算该混合物中A与B的物质的量之比。
A:CH3OH B:CH3CH2OH n(A):n(B)=3:4
解析:
根据饱和一元醇与金属钠反应产生H2的物质的量关系可知:
2R—OH+2Na![]() 2RONa+H2↑
2RONa+H2↑
2 mol 1 mol
n mol ![]() =0.06 mol
=0.06 mol
所以A和B混合物的总物质的量为0.12 mol。
设A、B形成混合醇的平均摩尔质量为![]() ,
,
则有![]() =
=![]() =40 g·mol-1,即平均相对分子质量为40。由于饱和一元醇CnH2n+1OH中只有甲醇的相对分子质量32<40,故可推知A为甲醇,B比A多一个碳原子,所以B为乙醇。
=40 g·mol-1,即平均相对分子质量为40。由于饱和一元醇CnH2n+1OH中只有甲醇的相对分子质量32<40,故可推知A为甲醇,B比A多一个碳原子,所以B为乙醇。
A:CH3OH,B:CH3CH2OH
利用十字交叉法可以快捷地求得A与B的物质的量之比:
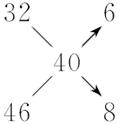
![]()

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目