题目内容
两种饱和一元醇A和B的分子中相差一个碳原子,现有A和B的混合物19.5 g与足量的钠反应生成了5.6 L H2(标准状况)。问A、B为何种物质?混合物中A、B的质量分数为多少?
【答案】
A:甲醇:41%;B:乙醇:59%。
【解析】
试题分析:5.6L氢气的物质的量是0.25mol
这说明有5.6 L H2生成说明有0.5 mol羟基
即混合醇的物质的量为0.5 mol
则混合醇的平均相对分子质量为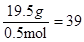
则必然A为甲醇,B为乙醇
设甲醇和乙醇的物质的量分别是x和y
则x+y=0.5mol
另外32x+46y=19.5g
解得x=压=0.25mol
因此甲醇、乙醇质量分别是8g和11.5g
则甲醇的质量分数是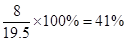
乙醇就是51%
考点:考查醇和金属钠反应的有关计算
点评:该题是中等难度的试题,试题基础性强,难易适中。在注重对基础知识考查对同时,更侧重能力的培养和解题方法以及技巧的指导与训练,有利于培养学生的规范答题能力和严谨的逻辑推理能力。

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目