题目内容
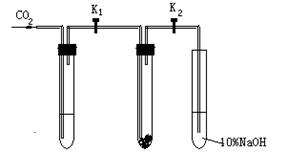
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图的实验装置,分别进行甲、乙两次实验:

实验甲:干燥的二氧化碳和过氧化钠的反应:在干燥的试管 Ⅱ 中装入过氧化钠,在通入二氧化碳前,关闭K1和K2。在试管I内装入试剂X后,打开K1和K2,通入二氧化碳,几分钟后,将带火星的木条插入试管 Ⅲ 的液面上,观察到木条不复燃,且 Ⅱ 中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应: 在试管I内装入试剂Y,其他操作同实验甲,观察到木条复燃,且 Ⅱ 中的淡黄色变为白色。
试回答下列问题:
(1)在装入过氧化钠后,通入二氧化碳前,关K1和K2 的目的是 。
(2)在实验甲中,试剂X是 ,其作用是 。在实验乙中试剂Y是 。
(3)根据上述两个实验现象,得到的结论是 。
(4)试管Ⅲ中的氢氧化钠溶液的作用是
(5)为了确保实验现象的准确性,制备二氧化碳所用的反应物最好选用 (填编号)。
A 大理石 B 小苏打 C 烧碱 D 盐酸 E 稀硫酸 F 稀硝酸
(6)CO2和Na2O2的反应机理可用示踪原子分析加以证明,请完成下列反应:
Na2O2+ C18O2 +H218O
(1)防止Na2O2受潮 (2) 浓硫酸,除去CO2中的水蒸气、水 (3)CO2只有在水存在时才能和Na2O2反应(4)除去O2中的CO2,便于检验O2产生 (5)BE(6)2Na2O2+2C18O2+2H218O=2Na2C18O3+2H2O+O2↑
解析:
(1)显然是为了形成一个密封环境,防止Na2O2受潮。(2)实验甲要求二氧化碳干燥,所以要用浓硫酸作干燥剂;实验乙要求二氧化碳潮湿,故可让CO2先通过水。(3)由实验现象可知甲无O2产生,乙有O2产生,从而可得出结论为CO2只有在水存在时才能和Na2O2反应;(4)制得的O2要纯度高,才能成功检验,所以之前要除杂(CO2);(5)若用大理石与盐酸制CO2会有HCl杂质,而图中无除杂装置,所以应选用小苏打(NaHCO3)与稀硫酸;(6)Na2O2中的O为-1价,在反应中一半变为0价,一半变为-2价,C18O2 和H218O中的18O的化合价不变。

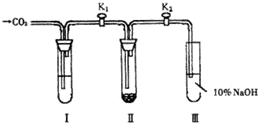 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,课题研究小组的同学们设计了如图所示的实验装置,分别进行甲、乙两次实验: