题目内容
 能源是现代社会发展的支柱之一,化学能是重要的能源.
能源是现代社会发展的支柱之一,化学能是重要的能源.(1)下列反应中,属于吸热反应的是
a
a
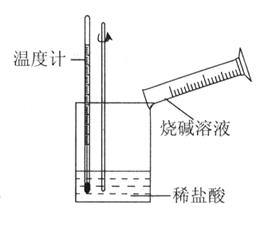
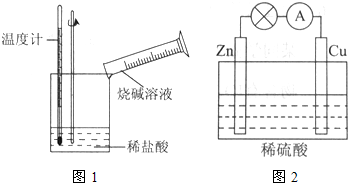
(填选项序号).a.Ba(OH)2?8H2O与NH4Cl混合搅拌 b.生石灰加入水中c.盐酸与NaOH溶液反应 d.H2在O2中燃烧(2)某同学进行如右图所示实验,测量铝与盐酸反应中的能量变化.实验表明:反应温度升高,由此判断铝与盐酸反应是
放热
放热
(填“吸热”或“放热”)反应,其离子方程式是2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
,其中还原剂是Al
Al
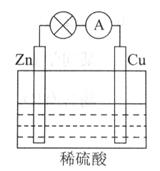
(填化学式).(3)电能是现代社会应用最广泛的能源之一.下图所示为锌、铜和稀硫酸组成的原电池,其负极是
Zn
Zn
,正极的电极反应式是2H++2e-=H2↑
2H++2e-=H2↑
.若电路中有1mol电子转移,则在标准状况下产生H2的体积为11.2
11.2
L.
分析:(1)根据常见的吸热反应和放热反应来回答;
(2)金属铝和酸的反应是放热反应,化合价升高元素所在的反应物是还原剂;
(3)原电池中,活泼金属做负极,在正极上发生得电子的还原反应,电极反应遵循电子守恒.
(2)金属铝和酸的反应是放热反应,化合价升高元素所在的反应物是还原剂;
(3)原电池中,活泼金属做负极,在正极上发生得电子的还原反应,电极反应遵循电子守恒.
解答:解:(1)a、Ba(OH)2?8H2O与NH4Cl混合搅拌后二者的反应为吸热反应,故a正确;
b、生石灰和水反应生成氢氧化钙的反应是放热反应,故b错误;
c、酸碱中和反应属于放热反应,故c错误;
d、物质的燃烧反应为放热反应,故d错误.
故选a;
(2)金属铝和酸的反应实质是2Al+6H+=2Al3++3H2↑,属于放热反应,,其中铝元素化合价升高,所以金属铝是还原剂,故答案为:放热;2Al+6H+=2Al3++3H2↑;Al;
(3)锌、铜和稀硫酸组成的原电池,其负极是较活泼的金属锌,正极是金属铜,正极的电极反应式是:2H++2e-=H2↑,若电路中有1mol电子转移,所以生成氢气的物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,
故答案为:Zn;2H++2e-=H2↑;11.2.
b、生石灰和水反应生成氢氧化钙的反应是放热反应,故b错误;
c、酸碱中和反应属于放热反应,故c错误;
d、物质的燃烧反应为放热反应,故d错误.
故选a;
(2)金属铝和酸的反应实质是2Al+6H+=2Al3++3H2↑,属于放热反应,,其中铝元素化合价升高,所以金属铝是还原剂,故答案为:放热;2Al+6H+=2Al3++3H2↑;Al;
(3)锌、铜和稀硫酸组成的原电池,其负极是较活泼的金属锌,正极是金属铜,正极的电极反应式是:2H++2e-=H2↑,若电路中有1mol电子转移,所以生成氢气的物质的量为0.5mol,体积为0.5mol×22.4L/mol=11.2L,
故答案为:Zn;2H++2e-=H2↑;11.2.
点评:本题考查学生常见的吸热反应和放热反应以及原电池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
能源是现代社会发展的三大支柱之一。化学在提高能源的利用率和开发新能源中起到了重要的作用。
(1)下列说法中,正确的是 。(填序号)
| A.煤、石油和天然气都是可再生的能源 |
| B.目前使用的手机电池为二次电池,放电时是将化学能转化为电能 |
| C.人体运动所消耗的能量与化学反应无关 |
| D.人类目前所直接利用的能量大部分是由化学反应产生的 |
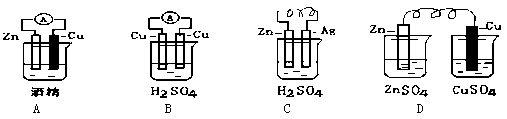
(3)锌锰干电池是目前使用最广泛的一种电池,其正极材料是石墨棒,它在放电时总反应式可表示为:Zn+ 2 MnO2 + 2 NH4+ ="=" Zn2+ + Mn2O3(S)+ 2NH3 + H2O。写出该电池负极反应的电极反应式 。当电极锌消耗6.5g时,可对外提供的电子是 mol。
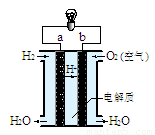
(4)右图是氢氧燃料电池构造示意图(电解质溶液为稀硫酸)。关于该电池的说法不正确的是
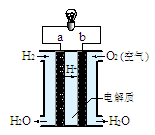
①.a极是负极
②.正极的电极反应是:O2+2H2O+4e-=4OH-
③.该装置可以将化学能完全转化为电能
④.氢氧燃料电池是环保电池
(5)人类在使用能源的过程中会产生环境问题。利用化学反应可以有效的进行治理。减少汽车等机动车尾气污染可在汽车尾气系统中增加催化转化装置,尾气中的CO、NO在催化剂的作用下反应生成两种参与大气循环的无毒气体,写出该反应的化学方程式 。
 能源是现代社会发展的支柱之一.
能源是现代社会发展的支柱之一.