题目内容
(10分)如图所示3套实验装置,分别回答下列问题。
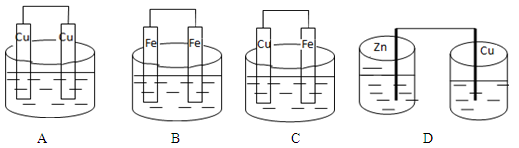
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
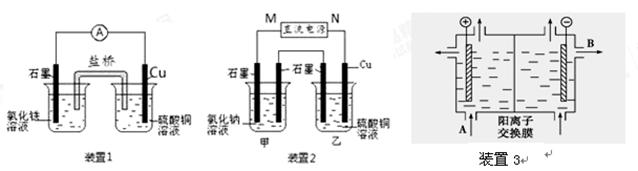
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________

(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
(1)负 2Fe3+ + Cu = 2Fe2+ + Cu2+
(2) ①正
②2Cu2+ + 2H2O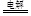 2Cu + O2 ↑ + 4H+
2Cu + O2 ↑ + 4H+
(3) ① A: 饱和NaCl溶液; B :稀NaOH溶液
② 2Cl- + 2H2O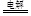 Cl2 ↑+ H2 ↑+ 2OH-
Cl2 ↑+ H2 ↑+ 2OH-
(2) ①正
②2Cu2+ + 2H2O
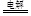 2Cu + O2 ↑ + 4H+
2Cu + O2 ↑ + 4H+(3) ① A: 饱和NaCl溶液; B :稀NaOH溶液
② 2Cl- + 2H2O
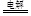 Cl2 ↑+ H2 ↑+ 2OH-
Cl2 ↑+ H2 ↑+ 2OH-试题分析:⑴装置1为原电池,铜为负极,被氧化,石墨正极,其电池总反应为2Fe3++Cu═2Fe2++Cu2+;
⑵向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极反应生成OH-,该极应为电解池的阴极,则M为电源的正极,N为电源的负极,由此可知甲为电解食盐水装置,而乙为电解硫酸铜溶液的装置,其阳极生成氧气,阴极生成铜,则电解的离子方程式为2Cu2++2H2O
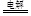 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;⑶根据电解池中阴离子移向阳极,阳离子移向阴极,图示装置中的交换膜是阳离子交换膜,A出口主要是饱和NaCl溶液,B出口主要是氢氧化钠溶液,甲装置是电解饱和食盐水,电解氯化钠溶液时生成氢氧化钠和氢气、氯气,其电解反应的离子方程式为:2Cl-+2H2O
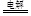 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目