��Ŀ����
����Ŀ��ú������������չ���磬��������ú�����������������������ˮú�����úΪԭ�ϵļ�ѹ����������ú������������ʾ��ͼ���£�
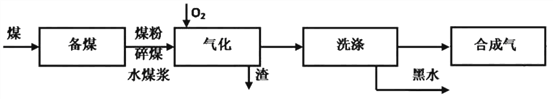
��1��ú�����������У��������·�Ӧ��
�� C��s��+O2(g) ![]() CO2(g) ��H1=��394.1kJ/mol
CO2(g) ��H1=��394.1kJ/mol
��2CO(g)+O2(g)![]() 2CO2(g) ��H2=��566.0kJ/mol
2CO2(g) ��H2=��566.0kJ/mol
��2H2(g)+O2(g)![]() 2H2O(g) ��H3=��483.6kJ/mol
2H2O(g) ��H3=��483.6kJ/mol
д������ˮú������ˮú�����Ȼ�ѧ����ʽ___________________��
��2��һ�������£���H2��CO��ֱ���Ʊ������ѣ�CH3OCH3���������л���ˮ�������������ͼ��ʾ��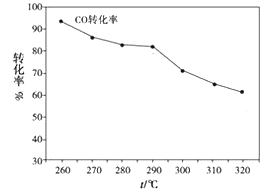
�ٺϳɶ����ѵĻ�ѧ����ʽΪ___________________________
������CO��ת�������¶ȵ����߶����͵�ԭ��_________________��
�������ڸ÷�Ӧ��ֽ��е�������______________ (����ĸ)
a.���µ�ѹ b.���¸�ѹ c.���¸�ѹ d.���µ�ѹ
����ʵ��������ѡ���������¶Ⱥ�ѹǿ��ԭ���ǿ�����________����
��3��ͼ�У���װ��ΪCH3OCH3����ȼ�յ�أ���缫��ΪPt�缫��װ�����У�C��D�缫ΪPb�缫��������������PbSO4������ҺΪϡH2SO4��Һ��
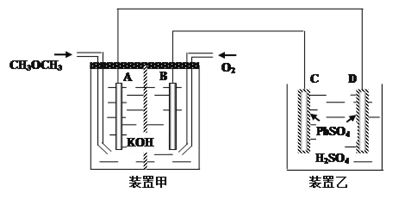
�� д����װ����B���ĵ缫��Ӧ____________________________
�� д����װ����D���ĵ缫��Ӧʽ___________________________
�� ����46�˶����Ѳμӷ�Ӧʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ____mol
���𰸡� C��s��+H2O(g)![]() CO(g)+H2(g) ��H=+130.7kJ/mol 4H2+2CO
CO(g)+H2(g) ��H=+130.7kJ/mol 4H2+2CO![]() CH3OCH3+H2O ��Ӧ����������ƽ��������COת���ʽ��� b ���ʡ��ɱ����豸���������Ե� O2+2H2O+4e-=4OH- PbSO4+2e-=Pb+SO42- 12
CH3OCH3+H2O ��Ӧ����������ƽ��������COת���ʽ��� b ���ʡ��ɱ����豸���������Ե� O2+2H2O+4e-=4OH- PbSO4+2e-=Pb+SO42- 12
����������1�������� C��s��+O2(g) ![]() CO2(g) ��H1=��394.1kJ/mol
CO2(g) ��H1=��394.1kJ/mol
��2CO(g)+O2(g)![]() 2CO2(g) ��H2=��566.0kJ/mol
2CO2(g) ��H2=��566.0kJ/mol
��2H2(g)+O2(g)![]() 2H2O(g) ��H3=��483.6kJ/mol
2H2O(g) ��H3=��483.6kJ/mol ![]()
ˮú�����Ȼ�ѧ����ʽC��s��+H2O(g)![]() CO(g)+H2(g) ��H=+130.7kJ/mol��
CO(g)+H2(g) ��H=+130.7kJ/mol��
��2������H2��CO��ֱ���Ʊ������ѣ�CH3OCH3���Ļ�ѧ����ʽΪ��4H2+2CO![]() CH3OCH3+H2O��
CH3OCH3+H2O��
���÷�Ӧ��һ�����ȷ�Ӧ�����ݻ�ѧƽ���ƶ�ԭ����֪�������¶ȣ�ƽ�����淴Ӧ�����ƶ�������CO��ת���ʽ��ή����
����ͼ��֪���¶ȵ����ߣ�CO��ת���ʽ��ͣ�˵���˷�ӦΪ���ȷ�Ӧ�����ݷ�Ӧ����ʽ֪�˷�Ӧ�����������С�ķ�Ӧ�����ѡ����¸�ѹ�������ڸ÷�Ӧ��ֽ��С��𰸣�b��
����ʵ��������ѡ�����¶ȹ��ͣ���ѧ��Ӧ̫����ͬʱ��������Ҳ��Ӱ�죻ѹǿ̫�ߣ��豸Ҫ��ͺܸߡ��ۺϸ�����������Ҫ���ǣ����ʡ��ɱ����豸���������Ե���
(3) ���״�ȼ�ϼ��Ե����,����ȼ�ϵĵ缫�Ǹ���,��AΪ����,BΪ����ͨ�������õ���,���B���ĵ缫��ӦΪO2+2H2O+4e-=4OH-;
����װ��Ϊ����,���ʱD����ԭ��صĸ����������������õ��ӣ���缫��ӦʽΪ��PbSO4+2e-=Pb+SO42-
�� �� CH3OCH3+16OH--12e-==2CO32-+11H2O
46 g 12mol
46g Xmol
X=12mol

 �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
