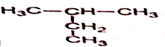题目内容
下列说法正确的是( )
| A、MgSO4晶体中只存在离子键 |
| B、含有共价键的化合物一定是共价化合物 |
| C、酸性:HNO3>H2CO3>H2SiO3 |
| D、普通钠玻璃成分可表示为Na2O?CaO?6SiO2,有固定的熔点 |
考点:离子化合物的结构特征与性质,元素周期律的作用,共价键的形成及共价键的主要类型,含硅矿物及材料的应用
专题:元素周期律与元素周期表专题,化学键与晶体结构,元素及其化合物
分析:A.硫酸镁中存在离子键和共价键;
B.含有共价键的化合物可能是离子化合物;
C.元素的非金属性越强,其最高价含氧酸的酸性越强;
D.玻璃不属于晶体,没有固定的熔点.
B.含有共价键的化合物可能是离子化合物;
C.元素的非金属性越强,其最高价含氧酸的酸性越强;
D.玻璃不属于晶体,没有固定的熔点.
解答:
解:A.硫酸镁中镁离子和硫酸根离子存在离子键,S原子和O原子之间存在共价键,所以硫酸镁中存在离子键和共价键,故A错误;
B.含有共价键的化合物可能是离子化合物,如KOH,故B错误;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性N>C>Si,所以其最高价含氧酸酸性HNO3>H2CO3>H2SiO3,故C正确;
D.玻璃不属于晶体,属于玻璃态物质,没有固定的熔点,故D错误;
故选C.
B.含有共价键的化合物可能是离子化合物,如KOH,故B错误;
C.元素的非金属性越强,其最高价含氧酸的酸性越强,非金属性N>C>Si,所以其最高价含氧酸酸性HNO3>H2CO3>H2SiO3,故C正确;
D.玻璃不属于晶体,属于玻璃态物质,没有固定的熔点,故D错误;
故选C.
点评:本题考查了化学键、酸性强弱的判断等知识点,根据物质的构成微粒确定化学键,根据元素的非金属性强弱判断其最高价含氧酸的酸性强弱,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列有关太阳能的说法不正确的是( )
| A、太阳能以光波形式传送到地面 |
| B、化石燃料蕴藏的能源来自太阳能 |
| C、太阳能是洁净能源,不污染环境 |
| D、食用植物体内的淀粉、蛋白质等属直接利用能源 |
IA族碱金属与VⅡA族元素所形成的化合物大都具有的性质是( )
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电.
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电.
| A、①②③ | B、③④⑤ |
| C、①④⑤ | D、②③⑤ |
核电荷数小于l8的某元素X,其原子的电子层数为n,最外层电子数为(2n+1),原子核内质子数为(2n2-1).下列关于元素X的说法中不正确的是( )
| A、其最高化合价一定为+5 |
| B、可以形成化学式为KXO3的盐 |
| C、其氢化物可以用来做喷泉实验 |
| D、其最高价氧化物的水化物是强酸 |
下列气态氢化物最稳定的是( )
| A、HF |
| B、HCl |
| C、HBr |
| D、H2S |
下列气体的收集方法正确的是( )
A、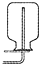 收集甲烷 |
B、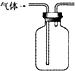 收集氨气 |
C、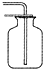 收集NO |
D、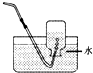 收集二氧化硫 |
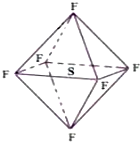 六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,有良好的绝缘性、阻燃,在电器工业方面具有广泛用途.下列推测正确的是( )
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,有良好的绝缘性、阻燃,在电器工业方面具有广泛用途.下列推测正确的是( )| A、SF6中各原子均达到8电子稳定结构 |
| B、SF6二氯取代物有3种 |
| C、SF6分子是含有极性键的非极性分子 |
| D、SF6是原子晶体 |
在下列溶液中,一定能大量共存的离子组是( )
A、常温下
| ||
| B、含有大量Al3+的溶液中:SO42-、S2-、AlO2-、ClO- | ||
| C、能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | ||
| D、常温下,在由水电离出的c(H+)=1×10-13mol?L-1的溶液中:K+、Fe3+、Cl-、SO42- |
 和
和
 和
和