��Ŀ����
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸx��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯����ͼ��ʾ�������жϳ���Ԫ�ػش�������

��1��y��Ԫ�����ڱ���λ����_____��
��2���Ƚ�g��h����̬�⻯��Ļ�ԭ��ǿ���ǣ�_____��_____��
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ_____��
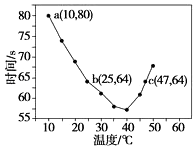
��4������Ԫ�ؿ������R��zx4f(gd4)2,��ʢ��10mL1molL�\1R��Һ���ձ��еμ�1molL�\1NaOH��Һ���������ʵ�����NaOH��Һ����仯ʾ��ͼ���£�

��д��m�㷴Ӧ�����ӷ���ʽ_____��
����R��Һ�ļ�20mL1.2 molL�\1Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ______mol��
���𰸡� �ڶ�����IVA�� H2S HCl 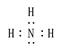 ��
��![]() ��
��![]() �� NH4��+OH�\=NH3��H2O 0.022mol
�� NH4��+OH�\=NH3��H2O 0.022mol
����������ͼʾ�õ�XΪH��yΪC��zΪN��dΪO��eΪNa��fΪAl��gΪS��hΪCl��
��1��yΪC��λ��Ϊ�ڶ�����IVA����
��2������������Cl����S�����Ի�ԭ��H2S����HCl��
��3��������ɵ���ԭ�ӹ��ۻ�����Ƚ϶࣬����ʹ�������������������Ȳ������ʽΪ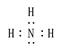 ��
��![]() ��
��![]() ��
��
��4��RΪNH4Al(SO4)2�����м����������ƣ��������������Ƚ�������ת��Ϊ���������������ٽ�笠����ӻû�Ϊ���������������������ת��ƫ��������ӡ�
������m��ӦΪNH4��+OH�\=NH3��H2O��
��NH4Al(SO4)2Ϊ0.01mol������笠�����0.01mol��������0.01mol�������0.02mol������20mL1.2 molL�\1Ba(OH)2��Һ��������0.024mol�����Ӻ�0.028mol���������ӡ�Ӧ������0.02mol���ᱵ�������Խ�0.01mol�����ӳ���Ϊ������������0.03mol���������ٷ�Ӧ0.01mol笠�������0.01mol��������ʣ��ĵ�0.048-0.03-0.01=0.008mol����������0.008mol����������ת��Ϊƫ��������ӣ�����ʣ��0.002mol�������������յij���Ϊ0.02+0.002=0.022mol��

 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�����Ŀ�������й�ʵ�������ȷ����
ѡ�� | ʵ�� | ���� |
A | ����Fe(NO3)2��Һ | ��Fe(NO3)2����ϡ�����У��ټ�ˮϡ�͵�����Ũ�� |
B | ֤���մ���Һ�д���ˮ��ƽ�� | ���з�̪���մ���Һ�м�������BaCl2���壬�۲���Һ��ɫ |
C | ����ӵ�ʳ���к��е�Ԫ�� | ȡ�����ӵ�ʳ�������Һ��Ȼ��μӵ�����Һ���۲���Һ��ɫ |
D | ȷ��H2SO3��H2CO3����ǿ�� | ��SO2��CO2�ֱ�ͨ��ˮ�дﵽ���ͣ���pH�������ⶨ��ҺpH,�Ƚ�pH��С |
A. A B. B C. C D. D
����Ŀ����þ����һ�ֹ�ҵ���ϣ���Ҫ�ɷ���MgO( ռ40%������CaO��MnO��Fe2O3��FeO��Al2O3��SiO2 �����ʣ��Դ�Ϊԭ����ȡ������þ��������ӡȾ��ѡֽ��ҽҩ�ȹ�ҵ������þ������ȡMgSO4��7H2O ����������:

��������ش���������:
��1��ʵ��������1mol/L������800mL������18.4mol/L��Ũ���������ƣ���ȡŨ����ʱ����ʹ�õ���Ͳ�Ĺ��Ϊ______��
A.10mL B.20mL C.50mL D.100mL
��2�������NaClO����Mn2+��Ӧ:Mn2+ +ClO-+H2O=MnO2 ��+2H++Cl-������һ������Ҳ�ᱻNaClO �������÷�Ӧ�����ӷ���ʽΪ____________________��
��3�����������Fe(OH)3��A(OH)3 ���_________________��
��4���ڡ����ơ�ǰ��������˲���Fe3+�Ƿ������������鷽��:_________��
��5����֪MeSO4��CaSO4���ܽ�����±�:
�¶�/�� | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�����ơ��ǽ�MgSO4��CaSO4�����Һ�е�CaSO4 ��ȥ�������ϱ����ݣ���Ҫ˵����������: _________��������I���ǽ���Һ����������������ȴ�ᾧ��______����õ���MgSO4��7H2O��
��6��ʵ�����ṩ����þ�100g���õ���MgSO4��7H2OΪ172.2 g����MgSO4��7H2O�IJ���Ϊ_____________________��