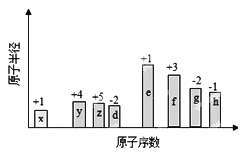
题目内容
【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
【答案】C
【解析】A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,A不符合题意;
B.a点时间为80s,浓度变化量为 ![]() =0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1,B不符合题意;
=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10﹣5molL﹣1s﹣1,B不符合题意;
C.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32﹣+2IO3﹣+2H+=5SO42﹣+I2+H2O,而图中c点的反应原理为2IO3﹣+5SO2+4H2O=5SO42﹣+I2+8H+,则图中b、c点对应的反应原理不一样,且温度不同,故反应速率不同,C符合题意;
D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,D不符合题意;
故答案为:C
A.结合图像中曲线的变化趋势分析即可;
B.先确定a点事浓度的变化量,再结合公式![]() 计算;
计算;
C.bc两点反应原理不同,无法比较反应速率;
D.根据题“55℃时未观察到溶液变蓝”确定不能用淀粉做指示剂;

 阅读快车系列答案
阅读快车系列答案