题目内容
8. 原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.
原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.
分析 根据原电池的定义分析;根据原电池中电极上得失电子判断正负极并写出电极反应式.
解答 解:原电池:把化学能转变为电能的装置;在Cu、Zn和稀硫酸组成的原电池中,锌失电子变成离子进入溶液,发生氧化反应,所以锌是负极,电极反应式为Zn-2e-=Zn2+.
故答案为:化学;电;负极;氧化;Zn-2e-=Zn2+.
点评 本题考查了原电池的定义、工作原理,写电极反应式时要注意电解质溶液的成分,电解质溶液不同,电极反应式可能不同,如氢氧燃料电池中电解质为酸或碱时,电极反应式就不同.

练习册系列答案
相关题目
18.下列离子方程式正确的是( )
| A. | 稀硫酸加入氢氧化钡溶液中:H++OH-=H2O | |
| B. | 铜片上滴加稀硝酸:3Cu+8H++2 NO3-═3Cu2++2NO↑+4H2O | |
| C. | 石灰石投入到稀盐酸中:CO32-+2 H+=CO2↑+H2O | |
| D. | Fe 粉加入稀盐酸中:2 Fe+6 H+=2 Fe3++3 H2↑ |
19.下列结果是马虎同学回答同桌提问的答案,你认为需要改正的是( )
①微粒半径:S2->Cl->S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
①微粒半径:S2->Cl->S>Cl ②氢化物稳定性:HF>HCl>H2S>PH3③还原性:Na>Mg>Al>K ④氧化性:Cl2>S>O2>F2 ⑤酸性:H2SO4>HClO4>H2SiO3>H3PO4 ⑥得电子能力:F>Cl>Br>I.
| A. | 只有③ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
3.下列叙述中,指定粒子的数目约为6.02×1023的是( )
| A. | 1.6gCH4中含有的电子数 | |
| B. | 100mL1mol/LH2SO4中含有H+的数 | |
| C. | 24gMg与足量稀盐酸反应转移的电子数 | |
| D. | 标准状况下,22.4LCO气体中含有的原子数 |
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等.如果从能量变化的角度来认识,下面说法中正确的是( )
| A. | 化学变化都是吸热的 | |
| B. | 化学变化都是放热的 | |
| C. | 化学反应前后反应物和生成物所含能量会发生变化 | |
| D. | 反应物所含能量等于生成物所含能量 |
20.如表所示的五种元素中,X、Y、Z、W为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法不正确的是( )
| X | Y | ||
| T | Z | W |
| A. | X、Y两种元素最低价氢化物的稳定性后者大 | |
| B. | Z、W 元素最高价氧化物对应的水化物酸性后者强 | |
| C. | X与Z形成的晶体类型为分子晶体 | |
| D. | T分别与X、Y、W 形成的化合物均具有熔点高,硬度大的特性 |
11.在一密闭容器中,反应aA(g)+bB(g)?cC(g),达到平衡时,测得c(A)为0.5mol•L-1;在温度不变的条件下,将容器体积扩大一倍,当重新达到平衡时,测得c(A)为0.3mol•L-1.则下列判断不正确的是( )
| A. | 化学计量数:a+b>c | B. | 平衡向逆反应方向移动了 | ||
| C. | 物质B的转化率增加了 | D. | 物质B的物质的量增加了 |
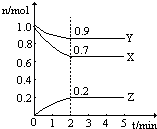 在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
 .
.
 .
. .
. .
.