题目内容
【题目】硫代硫酸钠俗称保险粉,实验室用SO2通入Na2S和Na2CO3的混合溶液中来制备硫代硫酸钠。
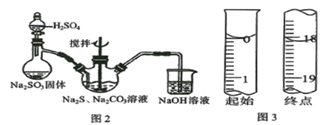
(1)用图2所示装置制取Na2S2O3,其中盛放Na2SO3固体的玻璃仪器名称是____________,三颈烧瓶中发生反应的化学方程式______________。
(2)保险粉样品中Na2S2O3·5H2O的纯度(质量分数)可通过氧化还原滴定法测定,相关反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。准确称取W g样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用0.1000 mol·L-1碘的标准溶液进行滴定。请回答:
①到达滴定终点的标志_______________。
②滴定起始和终点的液面位置如图3,则消耗碘的标准溶液体积为____mL,产品的纯度为______________(设Na2S2O3·5H2O相对分子质量为M)。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的纯度的测量结果___________(填“偏高”、“偏低”或“不变”)。
(3)某研究小组以硫代硫酸钠与硫酸反应来探究外界条件对反应速率的影响,设计实验如下:
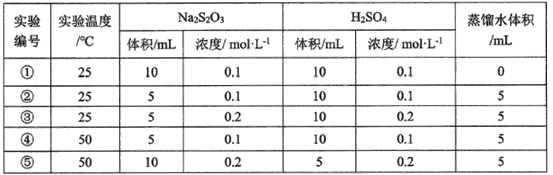
下列有关说法不正确的是__________________
A.该同学在实验中采用的研究方法是实验比较法
B实验①和②探究其他条件不变时Na2S2O3浓度对相关反应速率的影响
C.实验①和③溶液变浑浊的时间相同
D.其他条件不变时,探究温度对化学反应速率的影响,应选择实验③和⑤
【答案】蒸馏烧瓶 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 溶液变为蓝色,且30s内不恢复原色 18.10 ![]() 偏低 CD
偏低 CD
【解析】
(1)根据仪器的结构和性能确定盛放Na2SO3固体的玻璃仪器名称;三颈烧瓶中发生的反应是SO2通入Na2S和Na2CO3的混合溶液中生成硫代硫酸钠;
(2)①用配制的碘溶液滴定硫代硫酸钠,利用碘单质遇淀粉变蓝指示反应终点;
②终点读数与起点读数之差为消耗碘的标准溶液体积,根据方程式计算;
③局部变色就停止滴定,消耗标准溶液体积偏小,测定结果偏低;
(3)A.采取控制变量法对比实验探究外界条件对反应速率的影响;
B.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响;
C.实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,反应速率不相等;
D.实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等。
(1) 盛放Na2SO3固体的玻璃仪器是蒸馏烧瓶,三颈烧瓶中SO2通入Na2S和Na2CO3的混合溶液中生成硫代硫酸钠时发生反应的化学方程式为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(2)①用配制的碘溶液滴定硫代硫酸钠,滴入最后一滴碘的标准溶液,溶液变为蓝色,且30s内不恢复原色,说明反应到达终点;
②终点读数为18.10mL,起点读数为0.00mL,故消耗碘的标准溶液体积为18.10mL,
设Na2S2O35H2O的纯度为x,则:
2Na2S2O35H2O~2Na2S2O3~I2
2Mg 1mol
Wxg 18.10×10-3L×0.1000molL-1
故2Mg:Wxg=1mol:18.10×10-3L×0.1000molL-1,解得x=![]() %;
%;
③局部变色就停止滴定,消耗标准溶液体积偏小,会使样品中Na2S2O35H2O的纯度的测量结果偏低;
(3)A.采取控制变量法对比实验探究外界条件对反应速率的影响,故A正确,
B.实验①、②的温度相等,c(H2SO4)相等,c(Na2S2O3)不相等,故实验①、②是探究浓度对化学反应速率的影响,故B正确;
C实验①、③的温度相等,c(Na2S2O3)相等,c(H2SO4)不相等,③中c(H2SO4)较大,反应速率较快,变浑浊时间较短,故C错误;
D探究温度对化学反应速率的影响,应保证物质的浓度相等,而实验③、⑤温度不相等,c(H2SO4)和c(Na2S2O3)也均不相等,实验②、④中c(H2SO4)和c(Na2S2O3)均相等,但温度不等,故实验②、④是探究温度对化学反应速率的影响,故D错误;
故答案为CD。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案