题目内容
15. 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.反应Ⅰ2CO(g)+SO2(g)?2CO2(g)+S(1)△H1
(1)已知:反应Ⅱ2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应ⅢS(1)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1则△H1=-270KJ•mol-1.
(2)T℃时,起始将0.100mol CO(g)和0.120mol S02(g)充人2L恒容密闭容器中,发生反应Ⅰ,各物质的物质的量随时间变化如下表所示.
| 时间/min 物质的量/mol 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| CO(g) | 0.100 | 0.070 | 0.050 | 0.044 | 0.040 | 0.040 |
| SO2(g) | 0.120 | 0.105 | 0.095 | 0.092 | 0.090 | 0.090 |
A.容器内压强不再改变 B.每消耗2mol C02,同时生成2mol CO
C.气体密度不再改变 D.v正( S02)=2v逆(C02)
②0~2min内,用CO表示的该反应的平均速率v(CO)=-7.5×10-3mol?L-1?min-1;平衡时,S02的转化率为25%.
③t℃时,反应I的平衡常数K=50.
④t℃时,若将上述气体充人起始容积为2L的恒压密闭容器中,反应达到平衡时,S02的转化率与原平衡相比增大.(填“增大”、“减小”或“不变”).
(3)L(L1、L2),X可分别代表压强或温度.如图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系.
①X代表的物理量为压强.
②判断L1、L2的大小关系,并简述理由:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
分析 (1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g),利用盖斯定律计算△H1;
(2)①根据(1)中的反应2CO(g)+SO2(g)?2CO2(g)+S(1)可知,该反应为气体体积减小的放热反应,且气体质量不守恒,所以可以根据反应前后容器内的压强、密度以及正逆反应速率的关系判断反应是否处于平衡状态;
②根据$v=\frac{△c}{△t}$计算反应速率;S02的平衡转化率=$\frac{已转化的物质的量}{起始物质的量}$×100%;
③利用三段式计算,根据题中相关数据可知8分钟后达到平衡,据此计算得各物质的浓度
2CO(g)+SO2(g)?2CO2(g)+S(1)
起始(mol/L)0.05 0.06 0 0
转化(mol/L) 0.03 0.015 0.03
平衡(mol/L) 0.02 0.045 0.03
根据K=$\frac{{c}^{2}(CO{\;}_{2})}{{c}^{2}(CO)c(SO{\;}_{2})}$计算;
④由于该反应是气体体积减小的反应,所以恒压过程达到平衡时的压强比恒容过程达到平衡时的压强大,根据压强对平衡的影响判断;
(3)①、由图可知,X越大,CO(g)的体积分数越低;
②、由N2(g)+3H2(g)?3NH3(g)△H<0,升高温度,CO(g)的体积分数增大;
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式①×2-②得2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
所以其热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H1=-270KJ•mol-1,
故答案为:-270KJ•mol-1;
(2)①根据(1)中的反应2CO(g)+SO2(g)?2CO2(g)+S(1)可知,
A.该反应为气体体积减小的反应,所以容器内压强不再改变,则说明反应处于平衡状态,故A正确;
B.每消耗2mol C02,同时生成2mol CO,都是指的逆反应速率大小,无法判断正逆反应速率是否相等,故B错误;
C.恒容密闭容器中,该反应气体质量不守恒,所以气体密度不再改变,说明反应处于平衡状态,故C正确;
D.根据反应速率之比等于计量数之比可知,v正( S02)=2v逆(C02),说明正逆反应速率 不相等,故D错误;
故选AC;
②根据$v=\frac{△c}{△t}$可知,0~2min内,用CO表示的该反应的平均速率v(CO)=$\frac{\frac{0.1mol-0.07mol}{2L}}{2min}$=7.5×10-3mol?L-1?min-1;平衡时,S02的转化率=$\frac{0.12-0.09}{0.12}$×100%=25%,
故答案为:7.5×10-3mol?L-1?min-1;25%;
③利用三段式计算,根据题中相关数据可知8分钟后达到平衡,据此计算得各物质的浓度
2CO(g)+SO2(g)?2CO2(g)+S(1)
起始(mol/L)0.05 0.06 0 0
转化(mol/L) 0.03 0.015 0.03
平衡(mol/L) 0.02 0.045 0.03
所以K=$\frac{{c}^{2}(CO{\;}_{2})}{{c}^{2}(CO)c(SO{\;}_{2})}$=$\frac{0.0{3}^{2}}{0.0{2}^{2}×0.045}$=50,
故答案为:50;
④由于该反应是气体体积减小的反应,所以恒压过程达到平衡时的压强比恒容过程达到平衡时的压强大,根据压强对平衡的影响可知,反应达到平衡时,S02的转化率与原平衡相比增大,
故答案为:增大;
(3)①、由图可知,X越大,CO(g)的体积分数越低,增加压强平衡向正反应方向移动,则CO(g)的体积分数减小,则X表示压强,
故答案为:压强;
②、由2CO(g)+SO2(g)?2CO2(g)+S(1)△H<0,升高温度,CO(g)的体积分数增大,压强大,平衡正向移动,CO(g)的体积分数减小,图中等压时L2对应的CO(g)的体积分数小,则温度L1>L2,
故答案为:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
点评 本题考查了盖斯定律的应用、化学平衡影响因素分析判断、平衡常数的应用等,题目难度较大,侧重于考查学生对基础知识的综合应用能力.

| A. | H3PO4 | B. | H2SO4 | C. | HClO4 | D. | HBrO4 |
| A. |  | B. | 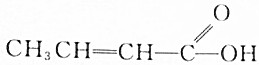 | ||
| C. | 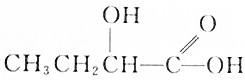 | D. | 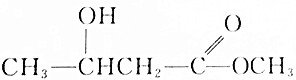 |

已知:Ag2SO4+4S2O32-═2[Ag(S2O3)2]3-+SO42-、Ag2CO3+4S2O32-═2[Ag(S2O3)2]3-+CO32-则下列说法中正确的是( )
| A. | 试样溶液中肯定存在S2O32-、CO32-,可能含有NH4+、Al3+、K+ | |
| B. | 沉淀1的成分肯定为BaSO4和S的混合物 | |
| C. | 将少量气体1通入溶液2中肯定会产生白色沉淀 | |
| D. | 取少量溶液1滴加KSCN溶液,溶液显红色 |
| A. | 将除铁锈后残余的稀硫酸倒入废液缸中 | |
| B. | 将制备氧气后残余的二氧化锰回收利用 | |
| C. | 将还原氧化铜后残余的一氧化碳点燃 | |
| D. | 将用剩的白磷溶解于CS2后倒入垃圾箱 |
| A. | N-H的键长比P-H的键长短,所以PH3的沸点比NH3低 | |
| B. | PH3分子的立体构型是三角锥形,与NH3互为等电子体 | |
| C. | PH3分子是极性分子,极易溶于水,因为它与水分子间存在氢键 | |
| D. | NH3比PH3稳定,因为NH3分子间存在氢键 |
 发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.