题目内容
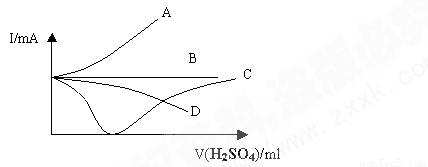
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)近似的用下图中的曲线表示是( )
C
解析试题分析:在氢氧化钡溶液中滴加硫酸时发生反应的离子方程式是Ba2++2OH- +2H+ +SO42-="=" BaSO4↓ +2 H2O,即在反应过程中导电性是降低的。但在反应结束后,继续滴加稀硫酸,导电性又逐渐增强,答案选C。
考点:考查溶液导电性强弱的有关判断
点评:溶液导电是靠阴阳离子的定向运动,所以影响溶液导电性强弱的因素是阴阳离子额浓度和离子所带电荷数,据此可以进行有关判断。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
 向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )