题目内容
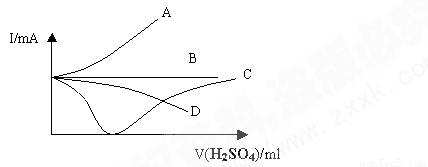
 向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )分析:溶液的导电能力取决于溶液中离子浓度的大小,根据氢氧化钡和硫酸的反应来确定离子浓度的变化,进而确定导电能力的变化.
解答:解:在没加硫酸之前,氢氧化钡具有一定导电能力,向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,开始反应,离子浓度逐渐减小,导电能力逐渐减弱,当恰好和氢氧化钡反应生成硫酸钡和水时,溶液的导电能力接近于零,然后随着硫酸的加入,导电的是硫酸溶液,所以导电能力会逐渐增加,直到和原来接近.
故选C.
故选C.
点评:溶液额导电能力和溶液中离子浓度的大小有关是解答本题的关键,注意硫酸和氢氧化钡之间反应的情况,难度不大.

练习册系列答案
相关题目